
分析 A、B、C、D均为短周期元素,原子序数逐渐增大,B为第11号元素,则B为Na,原子半径B>C>D>A,可知B、C、D同周期,A在第二周期,A、D同主族(第ⅥA),则A为O,D为S;C的最高价氧化物不溶于水,且为两性,能溶于B和D的最高价氧化物的水化物的水溶液中,可知C为Al,A、D的最外层电子数之和是B、C的最外层电子数之和的3倍,即6+6=(1+3)×3,符合上述推断,以此来解答.
解答 解:A、B、C、D均为短周期元素,原子序数逐渐增大,B为第11号元素,则B为Na,原子半径B>C>D>A,可知B、C、D同周期,A在第二周期,A、D同主族(第ⅥA),则A为O,D为S;C的最高价氧化物不溶于水,且为两性,能溶于B和D的最高价氧化物的水化物的水溶液中,可知C为Al,
(1)由上述分析可知,B为Na,C为Al,故答案为:Na;Al;
(2)A和D形成的化合物有SO2、SO3,故答案为:SO2;SO3;
(3)C与A的化合物和B与A的化合物的水溶液反应的方程式为Al2O3+2NaOH═2NaAlO2+H2O,故答案为:Al2O3+2NaOH═2NaAlO2+H2O.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的性质推断元素为解答的关键,侧重分析与应用能力的考查,注意周期律及元素化合物知识的应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.50mL | 18.60mL |
| 第二次 | 0.70mL | 19.00mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 202 | 2.6 |
| H2O2 | 423 | 以任意比互溶 |
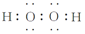
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
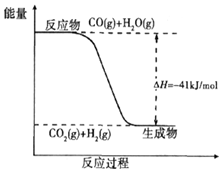 煤炭可以转化为清洁能源和化工原料.
煤炭可以转化为清洁能源和化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧菜用过的铁锅,经放置常出现红棕色斑迹 | |
| B. | 用煤气灶燃烧天然气为炒菜提供热量 | |
| C. | 牛奶久置空气中变质腐败 | |
| D. | 向沸水中滴入FeCl3饱和溶液,适当加热,制备胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com