
| 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 202 | 2.6 |
| H2O2 | 423 | 以任意比互溶 |
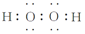
分析 (1)配位数为6,说明中心离子Fe2+,它的配体离子为6,Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,內界离子数为6,据此分析解答;
(2)判断Mn2+离子的原子核外3d轨道上是否含有电子来判断是否有颜色;金属键是金属阳离子和自由电子之间的强烈相互作用,一般来说,活泼金属与非金属形成离子键,非金属元素原子之间易形成共价键,含有空轨道的原子和含有孤电子对的原子之间易形成配位键,根据[Mn(H2O)6]2+的结构判断存在的化学键类型;
(3)①根据价层电子对互斥理论分析,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数;H2O2中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
②氢键影响物质的沸点和溶解性,含有氢键的物质沸点较高、溶解性较强.
解答 解:(1)Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,形成配位数为6的配合物,內界离子数为6,Fe(CN)2与KCN反应生成K4[Fe(CN)6],反应方程式为:Fe(CN)2+4KCN=K4[Fe(CN)6],所以配合物的化学式为:K4[Fe(CN)6],
故答案为:K4[Fe(CN)6];
(2)Mn2+离子的原子核外排布式为1s22s22p63s23p63d5,其d轨道上有5的电子,故[Mn(H2O)6]2+ 有颜色,Mn2+与H2O存在配位键,H2O中H与O形成极性共价键,即存在的化学键类型为配位键和极性共价键.
故答案为:有; CD;
(3)①H2O2分子中氧原子形成2个σ键,含有2对孤电子对,价层电子对个数=σ键个数+孤电子对个数=2+2=4,采取sp3杂化,H2O2为共价化合物,分子中存在两个氧氢键和一个O-O键,电子式为: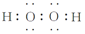 ,
,
故答案为:sp3;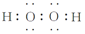 ;
;
②O元素非金属性较强,对应的氢化物能形成氢键,且与水分子之间也可以形成氢键,所以H2O2与水以任意比互溶,硫元素和水分子间不能形成氢键,标准状况时在水中的溶解度小,H2O2分子间形成氢键,所以H2O2的沸点比H2S高,
故答案为:H2O2分子间形成氢键;H2O2分子与H2O分子间形成氢键.
点评 本题考查较为综合,涉及配位键,电子式、杂化以及氢键等知识,题目难度中等,注意配合物的结构是易错点,学习中注意相关知识的积累.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据物质的组成元素是否单一,将纯净物分为单质和化合物 | |
| B. | 根据反应中的能量变化,将化学反应分为氧化还原反应、非氧化还原反应 | |
| C. | 根据电解质溶液导电能力强弱,将电解质分为强电解质、弱电解质 | |
| D. | 根据变化过程中是否有化学键的断裂,将物质变化分为物理变化和化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
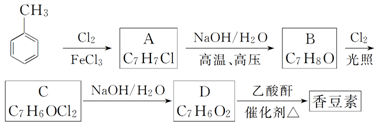
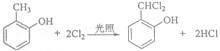 ;
;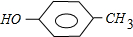 和
和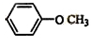 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com