
分析 (1)碳酸钡与盐酸反应生成氯化钡、二氧化碳气体和水;
(2)稀硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水;
(3)Fe与稀硫酸反应生成硫酸亚铁和氢气;
(4)氧化镁与稀硝酸发生反应生成硝酸镁和水,氧化镁不能拆开;
(5)该反应表示可溶性碳酸盐与可溶性钙盐或氢氧化钙生成碳酸钙沉淀和可溶性盐的一类反应;
(6)碳酸氢钠为强电解质,在溶液中完全电离出钠离子和碳酸氢根离子.
解答 解:(1)碳酸钡(BaCO3)和盐酸反应生成氯化钡、二氧化碳气体和水,反应的离子方程式为:BaCO3+2H+=Ba2++H2O+CO2↑,
故答案为:BaCO3+2H+=Ba2++H2O+CO2↑;
(2)H2SO4溶液与Ba(OH)2溶液反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
(3)铁与稀硫酸反应生成硫酸亚铁和氢气,反应的离子方程式为:Fe+2H+═Fe2++H2↑,
故答案为:Fe+2H+═Fe2++H2↑;
(4)氧化镁与稀硝酸反应生成硝酸镁和水,反应的离子方程式为:MgO+2H+═Mg2++H2O,
故答案为:MgO+2H+═Mg2++H2O;
(5)CO32-+Ca2+=Ca CO3↓表示可溶性碳酸盐与可溶性钙盐的一类反应,反应的化学方程式如:Na2CO3+CaCl2=CaCO3↓+2NaCl,
故答案为:Na2CO3+CaCl2=CaCO3↓+2NaCl;
(6)碳酸氢钠为强电解质,完全电离,其电离方程式为:NaHCO3═Na++HCO3-,
故答案为:NaHCO3═Na++HCO3-.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的考查,注意离子反应的意义及答案不唯一,题目难度不大.


科目:高中化学 来源: 题型:解答题

 ,K的结构简式为
,K的结构简式为 .
.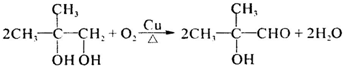 .
. $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,平衡向逆反应方向移动 | |
| B. | 加入少量CH3COONa固体,平衡向逆反应方向移动,c(CH3COO-)增大 | |
| C. | 加入少量0.1 mol•L-1HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小 | |
| D. | 加入少量NaOH固体,平衡向正反应方向移动,酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向.
以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向.查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com