
分析 ①根据化学式中原子数计算;
②同温同压下,体积之比等于物质的量比等于分子数之比;
③根据分子中H原子数计算;
④根据分子中含有的碳原子数计算.
解答 解:①0.1molFe2(SO4)3中含Fe3+的物质的量为0.2mol,其铁离子的数目为0.2NA;故答案为:0.2NA;
②同温同压下,体积之比等于物质的量比等于分子数之比,则等体积的CH4和C2H6两种气体所含分子数之比为1:1;
故答案为:1:1;
③等体积的CH4和C2H6两种气体所含分子数之比为1:1,则H原子数之比为4:6=2:3;
故答案为:2:3;
④等体积的CH4和C2H6两种气体所含分子数之比为1:1,则含有的碳原子数之比为1:2;
故答案为:1:2.
点评 本题考查了物质的量的计算,题目等浓度,明确物质的量与微粒之间的关系为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
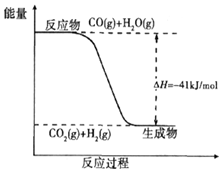 煤炭可以转化为清洁能源和化工原料.
煤炭可以转化为清洁能源和化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其反应化学平衡常数和T的关系如表所示:
在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其反应化学平衡常数和T的关系如表所示:| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C $\frac{\underline{\;←\;}}{\;}$O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为△H=-890kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890 kJ?mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 已知:H2(g)+F2(g)=2HF(g);△H=-270 kJ/mol,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 KJ | |
| D. | 在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com