
【题目】乙烯是来自石油的重要有机化工原料。结合以下路线回答:
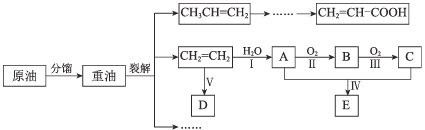
已知:2CH3CHO + O22CH3COOH
(1)D是高分子,用来制造包装材料,其结构简式是_________________ 。
(2)E有香味,实验室用A和C反应来制取E
①反应IV的化学方程式是_______________________________________ 。
②实验结束之后,振荡收集有E的试管,有无色气泡产生其主要原因是(用化学方程式表示)______
(3)产物CH2=CH-COOH可能发生的反应有____________(填序号)。
a. 加成反应 b. 取代反应 c. 氧化反应 d. 中和反应
(4)①A是乙醇,与A相对分子质量相等且元素种类相同的有机物的结构简式是:_____、_____。
②为了研究乙醇的化学性质,利用下列装置进行乙醇的催化氧化实验,并检验其产物,其中C装置的试管中盛有无水乙醇。(加热、固定和夹持装置已略去)
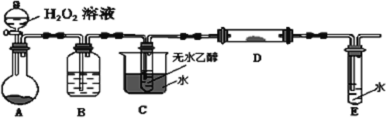
1)装置A圆底烧瓶内的固体物质是________,C中热水的作用是__________。
2)实验时D处装有铜粉,点燃D处的酒精灯后,D中发生的主要反应的化学方程式为__________,当反应进行一段时间后,移去酒精灯,D中仍然继续反应,说明D处发生的反应是一个________反应(填“吸热”或“放热”)。
【答案】![]() CH3COOH + C2H5OH
CH3COOH + C2H5OH![]() CH3COOC2H5 + H2O 2CH3COOH + Na2CO3=2CH3COONa + H2O + CO2↑ a b c d HCOOH CH3OCH3 MnO2 使乙醇汽化成乙醇蒸气 2CH3CH2OH+O22
CH3COOC2H5 + H2O 2CH3COOH + Na2CO3=2CH3COONa + H2O + CO2↑ a b c d HCOOH CH3OCH3 MnO2 使乙醇汽化成乙醇蒸气 2CH3CH2OH+O22![]() CH3CHO+2H2O 放热
CH3CHO+2H2O 放热
【解析】
乙烯与水经过步骤I发生加成反应生成乙醇,乙醇与氧气反应生成乙醛,乙醛氧化生成乙酸,乙酸与乙醇反应生成乙酸乙酯;乙烯发生加聚反应生成聚乙烯;
(1)D是高分子,用来制造包装材料,为聚乙烯,其结构简式为:![]() ;
;
(2)①E为乙酸乙酯,则乙醇与乙酸反应生成乙酸乙酯的方程式为:CH3COOH + C2H5OH![]() CH3COOC2H5 + H2O;
CH3COOC2H5 + H2O;
②加热时,挥发出的乙酸溶于乙酸乙酯中,振荡时与碳酸钠反应生成二氧化碳、水和乙酸钠,反应的方程式为:2CH3COOH + Na2CO3=2CH3COONa + H2O + CO2↑;
(3)CH2=CH-COOH含有的官能团为碳碳双键和羧基,可发生加成、氧化、加聚、还原和中和反应,故abcd全选;
(4)①乙醇的同分异构体为甲醚,乙醇分子去掉一个C、四个H时,可添加一个O,此时为甲酸;
②1)实验目的为乙醇的催化氧化,则装置A为制取氧气的装置,分液漏斗内盛有过氧化氢,则烧瓶内为催化剂二氧化锰;C中热水使乙醇变为蒸汽充分与氧气接触;
2)装置D中铜作催化剂,使乙醇蒸汽与氧气反应生成乙醛和水,反应的方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;一段时间后,移去酒精灯,D中仍然继续反应,说明该反应是一个放热反应,放出的热量能够维持反应持续进行。
2CH3CHO+2H2O;一段时间后,移去酒精灯,D中仍然继续反应,说明该反应是一个放热反应,放出的热量能够维持反应持续进行。


科目:高中化学 来源: 题型:
【题目】芳香族化合物 A(C9H12O)常用于药物及香料的合成,A 有如下转化关系:
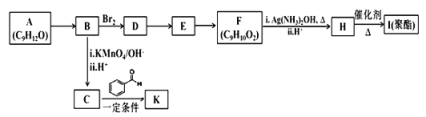
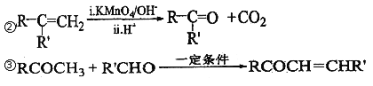
已知以下信息:①A 是芳香族化合物且分子侧链上有处于两种不同环境下的氢原子;
回答下列问题:
(1)B 生成 D 的反应类型为___________,由 D 生成 E 的反应所需的试剂及反应条件为_______。
(2)A 中含有的官能团名称为________________。
(3)K 的结构简式为________________________。
(4)由 F 生成 H 的反应方程式为________________________。
(5)F 有多种同分异构体,符合下列条件的同分异构体有__________种。
①属于芳香族化合物 ②能发生水解反应和银镜反应
(6)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(![]() )为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。____________________________
)为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]硼及其化合物用途非常广泛,回答下列问题。
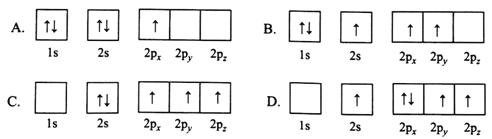
(1)下列B原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)
(2)H3BO3是一元弱酸,可用作医用消毒剂其水溶液呈酸性的原理为:
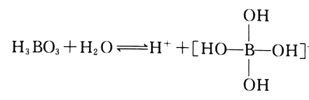
则1mol硼酸分子中含有的共用电子对数为________个。
(3)BF3可用于制造火箭的高能燃料,其分子的空间构型是________________,硼原子杂化方式是________________;BF3能与乙醚发生反应:(C2H5)2O+BF3→BF3·O(C2H5)2,该反应能发生,其原因是________________________________。
(4)硼的一种化合物结构简式为O=B—CH=C=CH2,该分子中含________个σ键。
(5)下图中图(a)为类似石墨的六方BN,图(b)为立方BN。
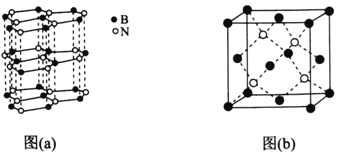
①六方BN具有良好的润滑性,是因为________________________;六方BN不能像石墨一样具有导电性,其原因是________________________。
②已知立方BN的晶胞参数为0.3615nm,阿伏加德罗常数的值为NA,则立方BN的密度为________________g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO(g)+Br2(g)![]() 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反应机理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是( )
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 正反应的活化能比逆反应的活化能小a kJ·mol-1
D. 增大Br2(g)浓度能增大活化分子百分数, 加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是( )

A. 放电时,负极的电极反应为:H2-2e-=2H+
B. 充电时,阳极的电极反应为:Ni(OH)2+OH--e-=NiO(OH)+H2O
C. 充电时,将电池的碳电极与外电源的正极相连
D. 放电时,OH-向镍电极作定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有关说法正确的是
A. 反应在0~3 s内的平均速率v(NO2)=0.24 mol·L1·s1
B. 在T温度下,起始时向容器中充入1.0mol NO2、0.5mol O3和0.50mol N2O5、0.50mol O2,反应达到平衡时,压强为起始时的0.88倍
C. 24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44mol·L1,则反应的ΔH>0
D. 在T温度下,起始时向容器中充入2.0mol N2O5和2.0mol O2,达到平衡时,N2O5的转化率大于20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。其中被氧化的元素是____________,还原产物是____________。
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg=Cu2HgI4+2Cu。
①上述反应产物Cu2HgI4中,Cu元素显________价。
②以上反应中的氧化剂为________,当有1 mol CuI参与反应时,转移电子________mol。
③标明上述反应电子转移的方向和数目。____________________________。
(3)工业上常用酸性高锰酸钾溶液处理含有CuS和Cu2S的矿物,其反应原理如下:
8MnO4—+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4—+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
根据上述反应原理,某学习小组用400 mL 0.075 mol·L-1的酸性高锰酸钾溶液处理2 g含有CuS和Cu2S的混合物。反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1的(NH4)2Fe(SO4)2溶液完全反应。
①配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:______,MnO![]() +Fe2++H+=Mn2++Fe3++H2O
+Fe2++H+=Mn2++Fe3++H2O
②KMnO4溶液与固体混合物反应后,剩余KMnO4的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性小组决定用实验探究的方法证明化学反应具有一定的限度。取5mL 0.1mol/L KI溶液于试管中,滴加0.1mol/L FeCl3溶液2mL,发生如下反应:2Fe3++2I-![]() 2Fe2++I2。为证明该反应具有可逆性且具有限度,他们设计了如下实验:
2Fe2++I2。为证明该反应具有可逆性且具有限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI),证明反应物没有反应完全;
②再取少量反应液,加入少量CCl4,振荡,发现CCl4层显浅紫色,证明萃取到I2,即有I2生成。综合①②的结论,他们得出该反应具有一定的可逆性,在一定条件下会达到反应限度。
(1)老师指出他们上述实验中①不合理,你认为是_____________________________;在不改变反应物用量的前提下,改进的方法是_____________________________________________。
(2)有人认为步骤②适合检验生成I2较多的情况下,还有一种简便方法可以灵敏地检验是否生成了I2,这种方法是______________________________。
(3)控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2,设计成如图所示的原电池。
2Fe2++I2,设计成如图所示的原电池。

①反应开始时,乙中石墨电极上发生____________(填“氧化”或“还原”)反应,电极反应式为_________________________。
②电流计读数为0时,反应达到平衡状态。此时在甲中加入FeCl2固体,发现电流计又发生偏转,则甲中的石墨作_______(填“正”或“负”)极,该电极的电极反应式为_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com