
| 序号 | 元素 | 结构及性质 |
| ① | A | A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5 |
| ② | B | B原子最外层电子数是内层电子总数的1/5 |
| ③ | C | C是常见化肥的主要元素,单质常温下呈气态 |
| ④ | D | D原子核外电子运动状态有13种 |
| ⑤ | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
| ⑥ | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
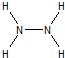 ,
, ;
;
| ||
| ||


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
| A、1:8 | B、2:5 |
| C、1:5 | D、5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①②④ |
| C、①③④ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量的Ba(OH)2与明矾[KAl(SO4)2?12H2O]加入足量水中:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |
| B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |
| C、H218O中投入Na2O2固体:2H218O+2Na2O2═4OH-+4Na++18O2↑ |
| D、CuCl2溶液中加入H2S溶液:Cu2++S2-═CuS↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定属于同一种元素 |
| B、可能是几种不同的分子或离子 |
| C、彼此之间互为同位素 |
| D、不可能是一种分子和一种离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com