
| 1.165g |
| 233g/mol |
| 100mL |
| 25mL |
| 100mL |
| 25mL |


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
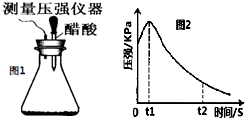 某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.| 编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
| ① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
| ② | 0.5 | 2.0 | 36.0 | |
| ③ | 碳粉质量的影响 | 0.2 | 2.0 | 90.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
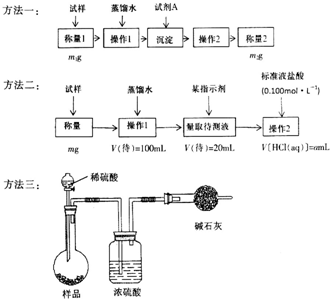 欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法.
欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KNO3溶液 |
| B、CaCl2溶液 |
| C、Na2SO4溶液 |
| D、Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
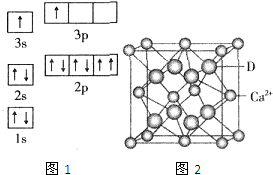 已知A、B、C、D、E五种元素的性质或结构信息如下,请根据信息回答下列问题:
已知A、B、C、D、E五种元素的性质或结构信息如下,请根据信息回答下列问题:| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:
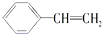 的下列叙述:①能使酸性KMnO4溶液褪色,②可发生加聚反应,③可溶于水,④可溶于苯中,⑤苯环能与溴水发生取代反应,⑥所有的原子可能共面.其中完全正确的是( )
的下列叙述:①能使酸性KMnO4溶液褪色,②可发生加聚反应,③可溶于水,④可溶于苯中,⑤苯环能与溴水发生取代反应,⑥所有的原子可能共面.其中完全正确的是( )| A、①②④ | B、①②④⑥ |
| C、①②④⑤⑥ | D、①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
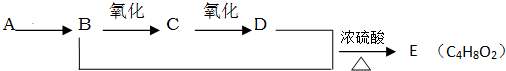
| 氧化 |
| 氧化 |
| 浓硫酸 |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com