
【题目】2A1+MoO3![]() Mo+Al2O3用于制备金属钼(Mo)。下列说法正确的是
Mo+Al2O3用于制备金属钼(Mo)。下列说法正确的是
A.Al得电子B.Al2O3 是氧化剂
C.MoO3 发生还原反应D.每生成1molMo有3mol电子转移
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
按下列合成步骤回答问题:

苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/°C | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了___________气体,发生的反应方程式______________________________。采用分液漏斗滴加溴的方式,这样的好处是_______________;c的作用_________________; 冷凝水的方向是________________(填写“上进下出”或者“下进上出”);
(2)液溴滴完后,经过下列步骤分离提纯:
(a)向a中加入10mL水,然后通过过滤除去未反应的铁屑;
(b)滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是_________;
(c)向分出的粗溴苯中加入少量的无水硫酸镁,静置、过滤。加入硫酸镁的目的是_____;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必须的是________(填入正确选项前的字母);
a.重结晶 b.过滤 c.蒸馏 d.萃取
(4)在该实验中,a的容积最适合的是___(填入正确选项前的字母)。
a.25mL b.50mL c.250mL d.500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaHCO3和Na2O2的固体混合物x g在密闭容器中加热至250℃,充分反应后排出气体.将反应后的固体溶入水无气体放出,再逐滴加入盐酸,产生气体(标准状况)与所加盐酸体积之间的关系如图所示.下列说法错误的是( )
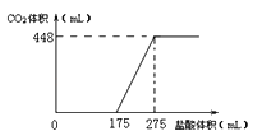
A.HCl的浓度0.2mol/L
B.反应后固体的成分为NaOH与Na2CO3
C.密闭容器中排出气体的成分为O2和H2O
D.x的数值为6.09
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学仿照“喷泉”实验的原理,在实验室中做了一个“喷烟”实验,如图所示。他在甲、乙两个烧瓶中分别充入X、Y两种无色气体,在胶头滴管中盛有含酚酞的NaOH溶液,实验时将胶头滴管内的液体挤入甲烧瓶内,然后打开止水夹,便可以看到甲烧瓶中的导管口喷出白色的烟,同时甲烧瓶中的溶液颜色逐渐变浅。若已知X、Y是HCl、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、NO其中气体中的两种,则下列判断中,正确的是( )
、NO其中气体中的两种,则下列判断中,正确的是( )

A.X是![]() ,Y是HClB.X是
,Y是HClB.X是![]() ,Y是
,Y是![]()
C.X是![]() ,Y是
,Y是![]() D.X是NO,Y是
D.X是NO,Y是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取硝基苯的主要步骤如下:
①将配制好的浓硫酸与浓硝酸的混合酸,冷却后加入试管中。
②向混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③水浴加热发生反应。
④反应结束后,待混合液冷却后转移至分液漏斗中,除去混合酸,粗产品依次用蒸馏水和10%的Na2CO3溶液洗涤,再用蒸馏水洗涤,得粗硝基苯。
⑤将粗硝基苯用无水CaCl2干燥后蒸馏得到纯硝基苯。

回答下列问题:
(1)配制一定比例浓硫酸和浓硝酸的混合酸的操作是___。
(2)步骤③中,水浴加热的优点是___。
(3)图中长玻璃导管的作用是___。
(4)写出制取硝基苯的化学方程式:___。
(5)步骤④中粗产品用10%的Na2CO3溶液洗涤的目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成下列问题:
(1)相对分子质量为72且沸点最低的烷烃的习惯名称是______。
(2)用系统命名法命名 ______
______
(3)某烯烃分子式为![]() ,其同分异构体中主链为4个碳原子的有_______种。
,其同分异构体中主链为4个碳原子的有_______种。
(4)合成高聚物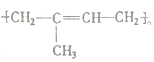 其单体的键线式______。
其单体的键线式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有__________个。
②LiBH4由Li+和BH4-构成,BH4-的空间构型是__________,B原子的杂化轨道类型是_____。
③某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_______(填元素符号),判断理由为_______________。
(2)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于____________。

(3)A原子的价电子排布式为3s23p5,铜与A 形成化合物的晶胞如图所示(黑点代表铜原子)。
①该晶体的化学式为______________。
②该化合物难溶于水但易溶于氨水,其原因是_____________ ,此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为____________。
③己知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,己知该晶体中Cu原子和A原子之间的最短距离为体对角线的1/4,则该晶体中Cu原子和A原子之间的最短距离为________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() 碳与适量水蒸气反应生成CO和H2,需吸收
碳与适量水蒸气反应生成CO和H2,需吸收![]() 热量,此反应的热化学方程式为_________________
热量,此反应的热化学方程式为_________________
(2)已知![]() ;
;![]()
![]() ;
;![]()
![]() ;
;![]()
常温下,取体积比4:1的甲烷和氢气的混合气体![]() (标准状况下),经完全燃烧后恢复至室温,则放出的热量为___________
(标准状况下),经完全燃烧后恢复至室温,则放出的热量为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,SO2和O2发生反应:2SO2(g)+O2(g)=== 2SO3(g),SO2的浓度随反应时间(t)的变化如下表。在0~10 s内,平均反应速率为( )
t/s | 0 | 5 | 10 | 15 |
SO2/(mol·L-1) | 0.82 | 0.40 | 0.32 | 0.28 |
A.v(SO2)=0.032 mol·L-1B.v(SO2)=0.050 mol·L-1
C.v(SO2)=0.050 mol·L-1·s-1D.v(SO2)=0.032 mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com