
X、Y、Z、W、G是元素周期表中原子序数依次增大的五种元素。X元素是元素周期表中核电荷数最小的元素。Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质。ZX3气体溶于水呈碱性。W的外围电子排布是3s1。G2+离子的M层d轨道只有5个电子。请回答下列问题:
(1)W在元素周期表中的位置是 ;W和Z形成的化合物水溶液呈碱性,用离子方程式表示其原因 。
(2)Z原子的第一电离能比氧原子的 (填“大”或“小”);G的基态原子电子排布式是
(3)X与Y可形成多种化合物,其中一种化合物的分子式是X6Y6,分子中只有σ键,该分子的结构简式是 ;该化合物中Y的杂化轨道类型是 。
(4)G的最高价氧化物对应水化物的钾盐,在酸性条件下,常用于测定溶液中Fe2+的含量,该反应的离子方程式是
(5)可用YX4还原ZOx以消除其污染。已知:
YX4 (g) +4ZO2 (g)=4ZO(g)+YO2(g)+2X2O(g) △H= - 574 kJ·mol-1
YX4 (g)+4ZO(g)=2Z2 (g)十YO2 (g) +2X2O(g) △H = -1160 kJ·mol-1
试写出用YX4还原ZO2至Z2的热化学方程式___ _。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年江西省高一下期中化学试卷(解析版) 题型:填空题
某同学为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折算为标准状况),实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大 ,
原因是 。
(2)哪一时间段的反应速率最小 ,原因是
(3)求2~3 min时间段以盐酸的浓度变化来表示的该反应速率 。
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液: A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是(填编号) 。
查看答案和解析>>
科目:高中化学 来源:2016届江西省赣州市十三县高三下期中理综化学试卷(解析版) 题型:填空题
【化学—选修5:有机化学基础】我国成功研制出丁苯酞,标志着我国在脑血管疾病治疗药物研究领域达到了国际先进水平。合成丁苯酞(J)的一种路线如下
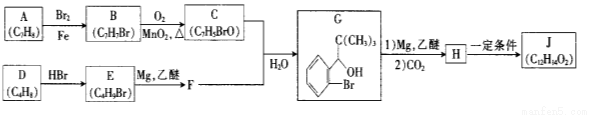
已知:①
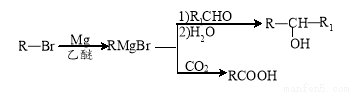
②E的核磁共振氢谱只有一组峰;
③J是一种酯,分子中除苯环外还含有一个五元环。
回答下列问题:
(1)对E的系统命名
(2)由B生成C反应类型为
(3)C中官能团名称为 ,C分子中最多有 个原子共平面。(已知甲醛中所有原子共面)
(4)由H生成J的化学方程式为 (写明反应条件)。
(5)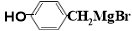 与CO2反应生成X,X的同分异构体中:
与CO2反应生成X,X的同分异构体中:
①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应。
满足上述条件X的同分异构体共有 种(不考虑超出中学范围的顺反异构和手性异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式 。
(6)参考题中信息和所学知识,写出由甲醛和化合物A合成2一苯基乙醇( )的路线流程图(其它试剂任选)。合成路线流程图表达方法例如下:
)的路线流程图(其它试剂任选)。合成路线流程图表达方法例如下:
查看答案和解析>>
科目:高中化学 来源:2016届吉林省吉林市高三第三次调研理综化学试卷(解析版) 题型:填空题
某实验组为研究“不同条件”对化学平衡的影响情况,进行了如下实验:一定条件下,向一个密闭容器中加入0.30molX、0.10molY和一定量的Z三种气体,甲图表示发生反应后各物质浓度(c)随时间(t)的变化〔其中t0~t1阶段c(Z)未画出〕。乙图表示化学反应速率(v)随时间(t)的变化,四个阶段都只改变一种条件(催化剂、温度、浓度、压强,每次改变条件均不同),已知t3~t4阶段为使用催化剂。
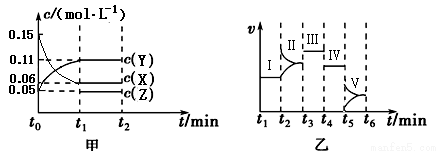
回答下列问题:
(1)若t1=5 min,则t0~t1阶段以X浓度变化表示的反应速率为v(X)= 。
(2)在t2~t3阶段Y的物质的量减小,则此阶段开始时v正 v逆(填“>”、“=”或“<”)。
(3)t4~t5阶段改变的条件为 ,此阶段的平衡常数K = 。
(4)t5~t6阶段容器内Z的物质的量共增加0.10 mol,在反应中热量变化总量为a kJ,写出该反应的热化学方程式 。在乙图Ⅰ~Ⅴ处平衡中,平衡常数最大的是 。
(5)若起始实验条件不变,重新向该容器中加入0.60 mol X、0.20 mol Y和0.080 mol Z,反应至平衡状态后X的转化率= 。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省吉林市高三第三次调研理综化学试卷(解析版) 题型:选择题
分子式为C7H12O4,其中只含二个—COOCH3基团的同分异构体(不考虑手性异构)共有
A.4种 B.5种 C.6种 D.7种
查看答案和解析>>
科目:高中化学 来源:2016届四川省雅安市三诊理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法中正确的是
A.常温常压下,0.1mol H2O2中含有极性共价键的数目为0.1NA
B.电解饱和食盐水时,当阴极产生22.4 L H2时,电路中转移的电子数为2NA
C.100mL 12mol·L-1的浓HNO3与过量Cu反应转移电子的数目为0.6NA
D.标准状况下,11.2L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA
查看答案和解析>>
科目:高中化学 来源:2016届四川省邛崃市高三强化训练一化学试卷(解析版) 题型:选择题
在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )

A.该反应的化学方程式为:3X+2Y 2Z
2Z
B.若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0
C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D.若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源:2016届四川省宜宾县高三第一次适应性测试理综化学试卷(解析版) 题型:填空题
电解精炼铜的阳极泥中含有多种贵重金属,从中提取金、银、铂的一种工艺如下:
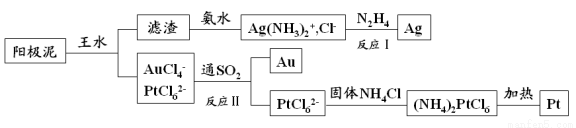
(1)王水是 的混合液,其体积比为 。
(2)滤渣的成分是 ,反应Ⅰ中肼(N2H4)的作用是 。
(3)反应Ⅱ的离子方程式为 ;当生成19.7gAu时,25℃和101kPa下反应消耗 L SO2(此条件下的气体摩尔体积为24.5L/mol,相对原子质量Au:197)。
(4)电解法精炼银时,粗银应与直流电源的 极(填“正”或“负”)相连,当用AgNO 3 和HNO 3 混合溶液做电解质溶液时,发现阴极有少量红棕色气体,则产生该现象的电极反应式为 。
(5)金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O,但该反应的平衡常数很小,所以金和浓硝酸几乎不反应,但金却可以溶于王水,原因是 。
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三5月模拟一理综化学试卷(解析版) 题型:选择题
下列有关电解质溶液中粒子浓度关系正确的是
A.pH=a的醋酸溶液,稀释10倍后,其pH=b,则a=b-1
B.含等物质的量的NaHSO3和Na2SO3的溶液:2c(Na+)=3[c(HSO3-)+c(SO32-)+c(H2SO3)]
C.0.1mol·L-1盐酸与0.2mol·L-1氨水等体积混合:c(NH3·H2O)>c(Cl-)>c(NH4+)>c(OH-)
D.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com