
【题目】已知 H2(g) + Cl2 (g)===2HCl(g) Δ H =- 184.6 kJ · mol-1则反应:HCl(g)===1/2H2(g)+1/2Cl2(g)的ΔH 为( )
A.+184.6 kJ·mol-1B.-92.3 kJ·mol-1
C.-369.2 kJ·mol-1D.+92.3 kJ·mol-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】室温下,取10 mL 0.1 molL1某二元酸H2A,滴加0.1 molL1 NaOH溶液。已知:H2A=H+ + HA-,HA-![]() H+ + A2-。下列说法正确的是
H+ + A2-。下列说法正确的是
A.A2-可经过两步水解得到H2A
B.当用去NaOH溶液体积10 mL时,溶液中离子浓度大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.当滴加至中性时,溶液中有c(Na+)=c(HA-) + c(A2-)
D.当用去NaOH溶液体积20 mL时,此时溶液中有c(Na+)=c(HA-) + c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是C5a受体拮抗剂W-54011的中间体,Nakamura等人设计制备H的合成路线如图所示:
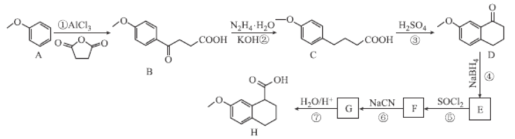
已知:Ⅰ.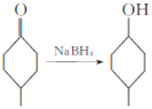 ;
;
Ⅱ.R-CN![]() R-COOH。
R-COOH。
回答下列问题:
(1)B中含氧官能团的名称为___。
(2)F的分子式为C13H13OCl,则F的结构简式为___。
(3)②⑤的反应类型分别为___、___。
(4)反应①的化学方程式为___。
(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳,写出化合物H与足量H2发生加成反应的产物的结构简式___,并用星号(*)标出其中的手性碳:
(6)Q与C互为同分异构体,Q遇FeCl3溶液发生显色反应,且苯环上连有两个取代基,1molQ与足量NaHCO3溶液反应最多产生1molCO2,则Q的同分异构体有___种(不含立体异构)其中核磁共振氢谱有6组吸收峰的结构简式为___(任写一种)。
(7)参照上述合成路线和信息,设计以苯乙醛为原料(其它试剂任选),制备![]() 的合成路线:___。
的合成路线:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,进行下图所示滴定并得到对应曲线。下列说法错误的是( )

A.Ka2(H2C2O4)=10-4.19
B.直线Ⅰ中X=![]()
C.在NaHC2O4溶液中c(H2C2O4)+c(H+)=c(OH-)+c(C2O42-)
D.Ⅰ、Ⅱ两条直线的斜率均为1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,冠以“绿色”的新概念不断产生,如绿色食品、绿色材料、绿色能源、绿色化学等,这里的“绿色”是对人类社会可持续发展战略的形象表述。“绿色化学”要求从经济、环保和技术上设计可行的化学反应。据此,由单质镁制硝酸镁的下列4个方案中,你认为可行而且符合“绿色化学”要求的方案是( )
A.![]()
B.![]()
C.Mg![]() MgO
MgO![]() Mg(NO3)2
Mg(NO3)2
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是

A. 放电时,多孔碳材料电极为负极
B. 放电时,外电路电子由多孔碳材料电极流向锂电极
C. 充电时,电解质溶液中Li+向多孔碳材料区迁移
D. 充电时,电池总反应为Li2O2-x=2Li+(1-![]() )O2
)O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个容积可变的容器中,通入3 mol SO2和2 mol O2及固体催化剂,使之发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=—196.6 kJ·mol-1,一段时间后达到平衡,平衡时容器内气体总的物质的量为起始时的90%.下列说法正确的是 ( )
2SO3(g) ΔH=—196.6 kJ·mol-1,一段时间后达到平衡,平衡时容器内气体总的物质的量为起始时的90%.下列说法正确的是 ( )
A.达到平衡时SO2的转化率约为33.3%
B.达到平衡时反应放出的热量为294.9 kJ
C.平衡时SO3的物质的量为2mol
D.达平衡时用O2表示的反应速率为0.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图乙是根据图甲的电解池进行电解时某个量(纵坐标x)随时间变化的函数曲线(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),这个量x是表示( )
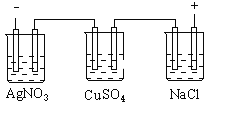
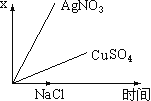
甲 乙
A. 各电池析出气体体积总数的变化B. 各电解池阳极质量的增加
C. 各电解池阴极质量的增加D. 各电极上放电的离子总数的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有![]() 、
、![]() 、
、![]() 、Cu。
、Cu。
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
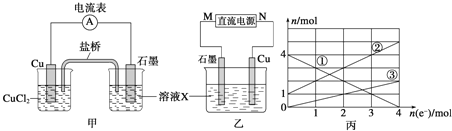
①图中X溶液的溶质是______________________;
②Cu电极上发生的电极反应式为_________________;
③原电池工作时,盐桥中的_______________离子![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 不断进入X溶液中。
不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是___________极;
②图丙中的②线是_______________离子的变化。
③当电子转移为2mol时,向乙烧杯中加入_________![]() 溶液才能使所有的金属阳离子沉淀完全。
溶液才能使所有的金属阳离子沉淀完全。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com