
【题目】用下列实验装置完成对应的实验,能达到实验目的的是( )
A. 制取并收集乙炔
制取并收集乙炔
B.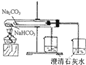 比较NaHCO3、Na2CO3的热稳定性
比较NaHCO3、Na2CO3的热稳定性
C.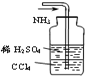 吸收多余的NH3
吸收多余的NH3
D.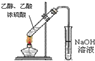 实验室中制取少量乙酸乙酯
实验室中制取少量乙酸乙酯
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】有机物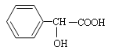 有多种同分异构体,其中符合属于酯类且能与氯化铁溶液发 生显色反应的同分异构体有多少种(不考虑立体异构)
有多种同分异构体,其中符合属于酯类且能与氯化铁溶液发 生显色反应的同分异构体有多少种(不考虑立体异构)
A.6 种B.9 种C.15 种D.19 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu2O。
(1)Cu2+基态核外电子排布式为__。O的基态电子排布图___。
(2)![]() 的空间构型为___(用文字描述);Cu2+与OH-反应能生成[Cu(OH)4]2-,[Cu(OH)4]2-中的配位原子为__(填元素符号)。
的空间构型为___(用文字描述);Cu2+与OH-反应能生成[Cu(OH)4]2-,[Cu(OH)4]2-中的配位原子为__(填元素符号)。
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为__;推测抗坏血酸在水中的溶解性:__(填“难溶于水”或“易溶于水”)。
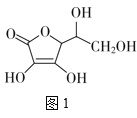
(4)一个Cu2O晶胞(如图2)中,Cu原子的数目为___。
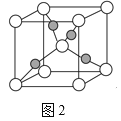
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示转化关系(X代表卤素),说法不正确的是

A.2H(g) +2X(g) == 2HX(g) ΔH3<0
B.途径Ⅰ生成HX的反应热与途径无关,所以ΔH1 = ΔH2 + ΔH3
C.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多
D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2。在500℃下发生发应,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
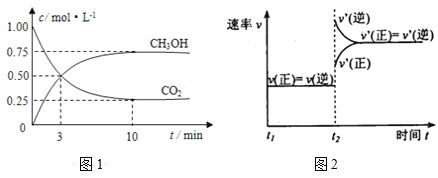
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=________。
(2)500℃该反应的平衡常数为_____(结果保留一位小数),图2是改变温度时化学反应速率随时间变化的示意图,若提高温度到800℃进行,达平衡时,K值_____(填“增大”“减小”或“不变”)。
(3)下列措施中不能使CO2的转化率增大的是_______。
A 在原容器中再充入1mol H2 B 在原容器中再充入1molCO2
C 缩小容器的容积 D 使用更有效的催化剂 E 将水蒸气从体系中分离出
(4)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正)____ v(逆)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
A. 反应前5秒钟内,用NO表示的平均反应速率为0.lmol·L-1·s-1
B. 达到平衡后,升髙温度,正反应速率将减小,逆反应速率将增大
C. 达到平衡后,反应速率的关系有:V正(CO)=2v逆(N2)
D. 保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2mol两种气态烃组成的混合气完全燃烧后得到6.72L二氧化碳(标准状况下)和7.2g水,下列关于该混合烃说法正确的是( )
A.一定有乙烯B.一定有甲烷
C.一定是甲烷和乙烯的混合气体D.可能有乙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二氮是白色固体,熔点为30℃,升温时易液化和气化,并发生以下两个相互联系的反应:①N2O5(g)![]() N2O3(g)+O2(g)②N2O3(g)
N2O3(g)+O2(g)②N2O3(g)![]() N2O(g)+O2(g)在0.5L密闭容器中,将2.5molN2O5加热气化,并按上述①②两式分解,在某温度下达到平衡,测得O2的平衡浓度为4.4mol/L,N2O3的平衡浓度1.6mol/L,则下列各项判断正确的是( )
N2O(g)+O2(g)在0.5L密闭容器中,将2.5molN2O5加热气化,并按上述①②两式分解,在某温度下达到平衡,测得O2的平衡浓度为4.4mol/L,N2O3的平衡浓度1.6mol/L,则下列各项判断正确的是( )
A.N2O5的转化率为60%
B.平衡时N2O3的物质的量为0.7mol
C.N2O5的平衡浓度为3.0mol/L
D.N2O的平衡浓度为4.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(1)通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表:
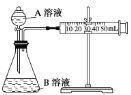
序号 | A溶液 | B溶液 |
① | 2mL0.1mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液 |
② | 2mL0.2mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液 |
③ | 2mL0.2mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液和少量MnSO4 |
该实验探究的是___对化学反应速率的影响。在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是___(用实验序号填空)。
(2)某组同学利用如图完成该实验。请分析导管a的两点作用:①___;②___。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com