
����Ŀ��X��Y��Z��W��Ԫ�����ڱ��еĶ�����Ԫ�أ����ǵ����λ�����±���ʾ������X��Y Ԫ�ؾ����γ�10���ӵ��⻯�Z��ԭ��������Y��2������ش��������⣺
X | Y | |
Z | W |
(1)W�ļ����ӵĽṹʾ��ͼΪ______��YԪ�������ڱ��е�λ����____��
(2)д��ʵ������WԪ�ص��ʵ����ӷ���ʽ��___________
(3)����Wͬ����Ԫ�أ�����˵����ȷ���ǣ�__________
A.���ϵ����ܶ�������
B.���ϵ����۵�ͷе㶼������
C.���ϵ���Ԫ�صķǽ�����Խ��Խǿ
D.ͬ����Ԫ�ض�Ӧ�ĵ����У�ֻ��WԪ�ض�Ӧ�ĵ����ڳ�̬��Ϊ��̬
(4)W��Z�γɵ�Һ�廯����Z2W2�������ʿ���ˮ��Ӧ����ZO2���壬1 mol Z2W2�μӷ�Ӧʱת��1.5 mol���ӣ�����ֻ��һ��Ԫ�ػ��ϼ۷����ı䣬Z2W2��ˮ��Ӧ�Ļ�ѧ����ʽΪ_____��
���𰸡� �ڶ����ڵڢ�A�� MnO2+4H++2Cl-
�ڶ����ڵڢ�A�� MnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O AB 2S2Cl2+2H2O=SO2�� +3S��+4HCl
Mn2++Cl2��+2H2O AB 2S2Cl2+2H2O=SO2�� +3S��+4HCl
��������
X��Y��Z��W��Ԫ�����ڱ��еĶ�����Ԫ�أ��������ǵ����λ�ÿ�֪X��Y�ǵڶ����ڵ�Ԫ�أ�Z��W�ǵ������ڵ�Ԫ�أ�Y��Z��ͬһ�����Ԫ�أ�Z��ԭ��������Y��2������֪Y��OԪ�أ�Z��SԪ�أ���X��NԪ�أ�W��ClԪ�ء�
(1)W��Cl��17��Ԫ�أ�ԭ�ӻ��1�����ӱ�ΪCl-��Y��OԪ�أ�����ԭ�Ӻ�����Ӳ���������������ȷ��Ԫ�������ڱ���λ�ã�
(2)ʵ������Ũ������MnO2��ϼ�����ȡ������
(3)����Ԫ�������ɷ���Ԫ�����ʱ仯���ɣ�
(4)�������⣬���Ԫ�ػ��ϼ۱仯�����ת�ƹ�ϵ����ȷ����Ӧ����ʽ��
��������������֪X��NԪ�أ�Y��OԪ�أ�Z��SԪ�أ�W��ClԪ�ء�
(1)W��Cl��17��Ԫ�أ�ԭ�Ӻ�������Ų�Ϊ2��8��7��ԭ�ӻ��1�����ӱ�ΪCl-��Cl-�ṹʾ��ͼΪ ��Y��OԪ�أ���������Ų�Ϊ2��6����OԪ�������ڱ���λ��λ�ڵڶ����ڵڢ�A�壻
��Y��OԪ�أ���������Ų�Ϊ2��6����OԪ�������ڱ���λ��λ�ڵڶ����ڵڢ�A�壻
(2)��ʵ������Ũ������MnO2��ϼ�����ȡ��������Ӧ�����ӷ���ʽΪ��MnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O��
Mn2++Cl2��+2H2O��
(3) W��ClԪ�أ�ClԪ��λ��Ԫ�����ڱ���VIIA��
A.±��Ԫ�صĵ��ʶ���˫ԭ�ӷ��ӣ��ڹ�̬ʱ���ڷ��Ӿ��壬���ڴ��ϵ��·��Ӽ����������������Դ��ϵ����ܶ�������A��ȷ��
B.±�ص����ɷ��ӹ��ɵķ��Ӿ��壬���Ӽ����������ϵ�����������˷�����֮��������ʹ�����ۻ���������Ҫ��������������˴��ϵ���±�ص��ʵ��۵�ͷе㶼�����ߣ�B��ȷ��
C.���ϵ���Ԫ�ص�ԭ�Ӱ뾶������ԭ�ӻ�õ��ӵ��������������Ԫ�صķǽ�����Խ��Խ����C����
D.ͬ����Ԫ�ض�Ӧ�ĵ����У��ڳ�����Ϊ��̬����F2��Cl2��D����
�ʺ���ѡ����AB��
(4)W��Z�γɵ�Һ�廯����Z2W2��S2Cl2�������ʿ���ˮ��Ӧ����ZO2������SO2��1 mol Z2W2�μӷ�Ӧʱת��1.5 mol���ӣ�����ֻ��һ��Ԫ�ػ��ϼ۷����ı䣬SԪ�ػ��ϼ���+1�۱�Ϊ+4�ۣ���ClԪ�ػ��ϼ�û�з����仯��SԪ�ػ��ϼۻ��б�Ϊ0�ۣ���S2Cl2��ˮ��Ӧ�Ļ�ѧ����ʽΪ2S2Cl2+2H2O=SO2�� +3S��+4HCl��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������500 mL0.5mol/LNaOH��Һ���Իش��������⣺
��1����Ҫ��ȡNaOH���������Ϊ___��
��2�����Ʒ������������������裬���ں��������Ϻ��ʵ���������
����ʢ��NaOH���ձ��м���100mL����ˮʹ���ܽ⣬����ȴ�����¡�
�ڽ�NaOH��Һ��___ע��___�С�
�����ձ��м�������������ˮ��С��ϴ��___2��3�β���ÿ�ε�ϴ��Һ��ת����___��
�ܼ�����___�м�����ˮ��Һ��ӽ��̶���1��2cm��
�ݸ���___�μ�����ˮ���̶��ߣ��Ǻ�ҡ�ȡ�
��3�����²�����ʹʵ������NaOH��Һ��Ũ��ƫ�͵���___��
A������ʱ���ӿ̶��� B���ܽ����ձ�δ��ϴ��
C�������õ��ձ������� D������ƿ��ԭ��������������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��84����Һ��ƿ�岿�ֱ�ǩ��ͼ��ʾ������84����Һ��ͨ��ϡ��100��(���֮��)��ʹ�á���ش��������⣺
84����Һ
����Ч�ɷ֣�NaClO
�����1000ml
������������37.25%
���ܶȣ�1.2g.cm-3
(1)����84����Һ�������ʵ���Ũ��ԼΪ________mol��L-1������2λ��Ч���֣���
(2)ijͬѧȡ100 mL����84����Һ����ϡ�ͺ�����������ϡ�ͺ����Һ��c(Na��)_____mol��L-1(����С�����2λ)��
(3)��ͬѧ���ĸ���84����Һ�����䷽������NaClO��������230 mL��NaClO��������Ϊ37.25%������Һ��
����Ҫ����NaClO���������Ϊ___________g
�����������ɷֽ�Ϊ���¼�����
A.������ȷ��NaClO���壬�����ձ������������ˮʹ���ܽ⣬���ò���������
B.��Լ30mL����ˮ������ϴ���ձ��Ͳ���������ÿ�ε�ϴҺ����������ƿ��
C.��NaClO��ҺС�ĵ��ò�������������ƿ��D�����250mL����ƿ���Ƿ�©ˮ
E.������ˮֱ�Ӽ�������ƿ����Һ��ӽ��̶���
F.�ǽ�ƿ���������ߵ���ҡ����Һ
G.�ý�ͷ�ι�������ƿ����μ�������ˮ����Һ����͵�ǡ�����������
������������еĿհ״�_____________________����ȷ�IJ���˳����(����ĸ��д)��_______________������A�������ʱ������__________���ܽ��к���IJ�����
(4)��84����Һ����ϡ������ʹ�ÿ���������������ij����С����Ա��98%(�ܶ�Ϊ1.84g/ml)��Ũ��������100ml4.6mol/L��ϡ���ᣬ������ǿ��84����Һ��������������
�������Ƶ�ϡ�����У�H+�����ʵ���Ũ��Ϊ__________mol/L��
����Ҫ��ȡŨ��������Ϊ__________ml��
(5)�������Ƶ�ϡH2SO4���вⶨ������ʵ��Ũ��С��4.6 mol��L-1���������������Щ��������������Ũ��ƫС_______(����ĸ)��
A.����Ͳ��ȡŨ����ʱ��������Ͳ�Ŀ̶�
B.����ƿδ���T����������Һ
C.Ũ�������ձ���ϡ�ͺ�δ��ȴ������ת�Ƶ�����ƿ�У������ж���
D.������ƿת��ʱ��������Һ�彦��
E.ϴ����Ͳ�е�Һ��ע���ձ�
F.�ձ�δ����ϴ��
G.���ݺ�����ƿ������ҡ�ȣ����ú�Һ�治���̶��ߣ��ټ�ˮ���̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��PbCrO4��һ�ֻ�ɫ���ϣ��Ʊ�PbCrO4��һ��ʵ�鲽����ͼ1��
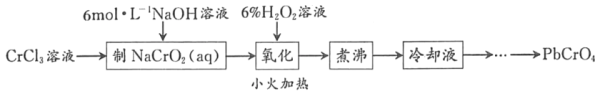
��֪����Cr��OH��3�����������������ɫ��������ˮ
��Pb��NO3��2��Pb��CH3COO��2��������ˮ��PbCrO4��KspΪ2.8��10��13��Pb��OH��2��ʼ����ʱpHΪ7.2����ȫ����ʱpHΪ8.7��
�����۸�����Һ�����ֲַ�������pH��ϵ��ͼ2��ʾ��
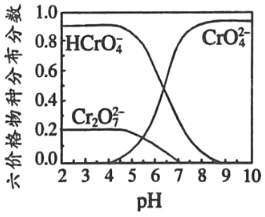
��PbCrO4���ɷ��ڵĸ�������Һ��Ǧ����Һ�����Ƶã���PbCrO4����ʱ��������
��1��ʵ��ʱ��Ҫ����100mL3molL��1CrCl3��Һ��������Ͳ�����������ձ�������Ҫ����������___��
��2������NaCrO2��aq����ʱ������NaOH��Һ�������IJ���������_____��
��3����������ʱH2O2�μ��ٶȲ��˹��죬��ԭ����_____����������ʱ������Ӧ�����ӷ���ʽΪ___��
��4�����������Ŀ����_____��
��5�������������ȴҺ���Ʊ�PbCrO4��ʵ�������_____[ʵ������ʹ�õ��Լ��У�6molL��1�Ĵ��ᣬ0.5molL��1Pb��NO3��2��Һ��pH ��ֽ]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о����������ſ��뱣��ϸ��Ĥ�ϵ�H+��ATPase���ŷdz����еĹ�ϵ��H+��ATPase�������յ������ͻ�����ATPˮ���ͷŵ�������H+���ڵ�ϸ���⣬��ʱ����K+����ͨ��������ϸ�����K+ת�ƽ�����ϸ����ͬʱ���������������H+Э����Ҳ���뱣��ϸ�����Ӷ�ʹ�����ſ��������ſ��˶�����ػ�������ͼ��ʾ��
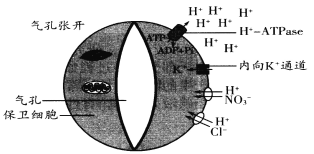
ע��ͼ������ϸ���������ײ���ϸ���ڽϺ������Խ�С�����ϱ�
��1������ϸ��Ĥ�ϵ�H+��ATPase������ʱ��ϸ���ڵ�H+ͨ��____________�ķ�ʽת�Ƴ�����ϸ������ϸ����ˮ��ʧˮ��ԭ���Ʋ⣬�����յ��������ſ���ԭ����__________________��
��2��ֲ����ʱΪ��ֹˮ�ֹ���ɢʧ����رգ���ʱҶ��ϸ���Կɽ��й�����ã����ĵ�CO2������___________��___________����������ʻ����Լ�����������˲��ֲ��Ҷ��ϸ������C5�����ʻ�___________�������С�����䡱����
��3��������Ա����ת�����������Ͻ汣��ϸ���б������ɹ���Ƶ�K+ͨ������BL����ͼ�������������������ǿʱ���״ĸ��죬���ռ���ʱ�رյ�Ҳ���졣
����̽��BL�����Ƿ��˴˹��ܣ����ڱ仯�Ĺ���ǿ�Ⱥͺ㶨����ǿ���£��ֱ������ֲ���ת����ֲ�������������ʵ����Ա�����_____________________��
����ʵ�����BL��������Ԥ�ڵ����ã����ں㶨����ǿ����������ת������ϵ���������ۺ���ˮЧ�ʷ��棬������ֲ�������Բ��죬˵��____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CO2��H2��CO��ɵĻ��������ͬ��ͬѹ���뵪�����ܶ���ͬ����û��������CO2��H2��CO�������Ϊ
A. 29��8��13 B. 22��1��14 C. 13��8��29 D. 44��2��28
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫʵ������У���˿����ϴ�����������ɫʵ��Ĺ۲����������ͼ��ʾ�����������в���ȷ���ǣ� ��

A.ÿ��ʵ���ж�Ҫ�Ƚ���˿���յ�������ɫ����պȡ����������
B.�ص���ɫʵ��Ҫ����ɫ�ܲ����۲�
C.��ɫʵ����ij�ֽ���Ԫ������ʱ�����е�������ɫ���ǻ�ѧ�仯
D.û�в�˿����������˿�������ʵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڸ��������£�����ѡ����ʾ�����ʼ�ת������ʵ�ֵ���
A. MgCO3![]() MgCl2(aq)
MgCl2(aq) ![]() Mg
Mg
B. NaCl![]() NaHCO3(s)
NaHCO3(s) ![]() Na2CO3(s)
Na2CO3(s)
C. SiO2![]() Si
Si![]() SiCl4
SiCl4
D. AgNO3![]() [Ag(NH3)2]OH(aq)
[Ag(NH3)2]OH(aq) ![]() Ag
Ag
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������������ǵ�����������ʡ�
��1���γ������ԭ��֮һ�ɼ�ʾ���£�
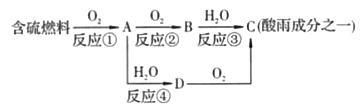
�ش��������⣺
�������pH________(���������������)5.6��
��D���ʵĻ�ѧʽΪ____________��
�۷�Ӧ�ڵĻ�ѧ����ʽΪ___________________________________��
��2����һ�������°��������������������ת��Ϊ����Ⱦ�����ʡ�д�������Ͷ���������һ�������·�Ӧ�Ļ�ѧ����ʽ��____________����Ӧ����������___________����ԭ����_______________��
��3��������������Һ�������շ����еĵ��������Ӧ�Ļ�ѧ����ʽ���£�
NO2��NO��2NaOH��2NaNO2��H2O
2NO2��2NaOH��NaNO2��NaNO3��H2O
����VLijNaOH��Һ����ȫ����n mol NO2��m mol NO��ɵĴ�����Ⱦ�
�������ռ���Һ�����ʵ���Ũ������Ϊ________mol��L��1��
����������Һ��c(NO3-)��c(NO2-)��1��9����ԭ���������NO2��NO�����ʵ���֮��n��m��________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com