
与CaC2一样,Mg3C2也是离子晶体,与水能发生复分解反应。关于Mg3C2的叙述正确的是
| A.与水反应有乙炔生成 | B.与水反应有Mg(OH)2生成 |
| C.有C-C键 | D.有C22-离子 |
 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:单选题
难溶物BaSO4在水中的溶解平衡可表示为:BaSO4(s) Ba2+(aq)+SO42-(aq)。其溶度积常数Ksp=C(Ba2+)·C(SO42-),某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
Ba2+(aq)+SO42-(aq)。其溶度积常数Ksp=C(Ba2+)·C(SO42-),某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
| A.D点无BaSO4沉淀生成 |
| B.加入Na2SO4可以使溶液由A点变到B点 |
| C.通过蒸发可以使溶液由D点变到C点 |
| D.A点对应的Ksp大于C点对应的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25oC时,pH=2的HCl溶液中,由水电离出的H+的浓度是( )
| A.1×10-7mol·L-1 | B.1×10-12mol·L-1 |
| C.1×10-2mol·L-1 | D.1×10-14mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
水的电离平衡曲线如图所示。下列说法错误的是
| A.水的电离常数KW数值大小关系为:b>c>d |
| B.a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO42- |
| C.温度不变,加入少量NaOH可使溶液从c点变到 a点 |
| D.在b点对应温度下,将pH=2的HCl与pH=10的NaOH溶液等体积混合后,溶液显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定温度下,水存在H2O ? H+ + OH- + Q(Q<0)的平衡,下列叙述一定正确的是
| A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 |
| B.将水加热,Kw增大,pH减小 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.向水中加入少量固体硫酸钠,c(H+)=10-7mol/L,Kw不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25℃时,2a mol·L-1HA水溶液中(HA为弱酸)。用NaOH调节溶液pH(忽略体积变化),得到c(HA)、c(A-)与溶液pH的变化关系如下图所示。下列说法错误的是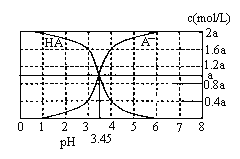
A.当pH=3时,溶液中c(A-)>c(Na+)
B.当c(A-)>c(HA),溶液一定呈碱性
C.当pH=3.45时,c(Na+)+c(H+)=c(HA)+c(OH-)
D.当pH=4时,溶液中:c(HA)+c(Na+)+c(H+)-c(OH-)=2a mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
弱电解质在水溶液里达到电离平衡时,溶液中已电离的电解质分子数占原总分子总数的百分数叫做该电解质的电离度。现欲粗略测定一未知浓度的醋酸溶液中醋酸的电离度,应做的实验和所需的试剂(或试纸)是
| A.电解、NaOH溶液 | B.蒸馏、Na2CO3溶液 |
| C.酯化反应、石蕊试液 | D.中和滴定、pH试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
为比较盐酸与醋酸的酸性强弱,下列方案不可行的是(均在常温下测定)
| A.比较等体积、等pH值的两种溶液的导电性 |
| B.比较等物质的量浓度的氯化钠与醋酸钠溶液的pH值 |
| C.比较等体积、等pH值的两种溶液与过量锌粉反应产生氢气的量 |
| D.比较等体积、等物质的量浓度的两种溶液稀释相同倍数后的pH变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某碱性溶液中只含有Na+、CH3COO-、H+、OH- 4种离子。下列描述正确的是
| A.该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| B.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 |
| C.该溶液中离子浓度一定为c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.加入一定量冰醋酸,c(CH3COO-)可能大于、等于或小于c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com