
【题目】如果只用一种试剂区别Na2SO4、MgCl2、Al2(SO4)3三种溶液,则该试剂为( )
A.NaOH溶液
B.BaCl2溶液
C.稀H2SO4
D.AgNO3溶液
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是 ( )
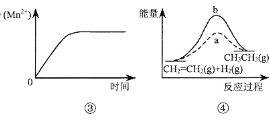
A.图③表示10 mL 0.01 mol·L-1 KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
B.图④中a、b曲线分别表示反应CH2=CH2 (g)+ H2(g)![]() CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
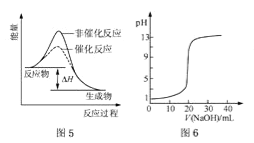
C.图5表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
D.图6表示0.1000mol L-1NaOH溶液滴定20.00mL0.1000mol L-1CH3COOH溶液所得到的滴定曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用。
I.(1)常温下中和100 mL pH=3的CH3COOH溶液和1 L pH=4的CH3COOH溶液,需要等物质的量浓度的NaOH溶液的体积分别为V1和V2,则V1_______V2(填“>”、“=”或“<”)。
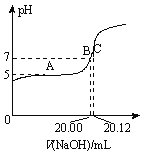
(2)常温下,用0.1000 mol/L的NaOH溶液滴定20.00 mL某未知浓度的CH3COOH溶液,滴定曲线如图所示。其中A点所示溶液中c(CH3COO-)=2c(CH3COOH),C点所示溶液中存在c(CH3COO-)+c(CH3COOH)=c(Na+)。则常温下CH3COOH的电离常数Ka=_________,CH3COOH溶液的实际浓度为____________。
Ⅱ.1100℃时,体积为2 L的恒容容器中发生如下反应:
Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)。
Na2S(s)+4H2O(g)。
(1)下列能判断反应达到平衡状态的是________。
A.容器中压强不变
B.混合气体密度不变
C.1 mol H-H键断裂同时形成2 mol H-O
D.H2的体积分数不变
(2)若2 min时反应达平衡,此时气体质量增加8 g,则用H2表示该反应的反应速率为___________。
(3)某温度下该反应达平衡状态,测得混合气体的平均相对分子质量为14,则该温度下的平衡常数K为_____________。
(4)若降低温度,K值减小,则反应的ΔH______0(填“>”或“<”)。
(5)若反应达平衡后,加入少量的H2,再次平衡后,H2O的体积分数___________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出(已知硝酸的还原产物是NH4NO3)。在反虑结束后的溶液中,逐滴加入5mol/L的NaOH溶液。所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如下图所示。
则下列说法错误的是:
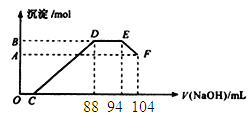
A. 铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为5:4
B. 原硝酸溶液中含硝酸的物质的量为0.5mol
C. B与A的差值为0.05 mol
D. 反应结束后的溶液仍有硝酸剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是( )
A.加入10mL 0.01mol·L-1的NaOH溶液 B.加入10mL 的水进行稀释
C.加水稀释成100mL D.加入10mL 0.01mol·L-1的盐酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项的两组物质在溶液中的反应,可用同一离子方程式表示的是( )
A.氢氧化钠与盐酸,氢氧化钠与碳酸
B.BaCl2溶液与Na2SO4溶液,Ba(OH)2溶液与H2SO4溶液
C.Na2CO3溶液与硝酸溶液,CaCO3溶液与硝酸溶液
D.石灰石与硝酸反应,石灰石与盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是
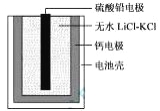
A.正极反应式:Ca + 2Cl--2e- = CaCl2
B.放电过程中,Li+向负极移动
C.常温时,在正负极间接上电流表或检流计,指针发生偏转
D.每转移0.1mol电子,理论上生成10.35 g Pb
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com