
【题目】有机物M的合成路线如下图所示:

已知:R—CH=CH2 ![]() R—CH2CH2OH 请回答下列问题:
R—CH2CH2OH 请回答下列问题:
(1)有机物B的系统命名为___________。
(2)F中所含官能团的名称为___________,F→G的反应类型为_______________。
(3)M的结构简式为___________。
(4)B→C反应的化学方程式为______________________________。
(5)X是G的同系物,且相对分子质量比G小14,X有多种同分异构体,满足与FeCl3溶液反应显紫色的有______种(不考虑立体异构),其中核磁共振氢谱显示有4种不同化学环境的氢,且峰面积比为1∶1∶2∶6的结构简式为_________________。
(6)参照M的合成路线,设计一条由丙烯和乙醇为起始原料制备丙酸乙酯的合成路线(无机试剂任选)____。
【答案】2-甲基-1-丙醇醛基、碳碳双键加成反应![]() 2(CH3)2CHCH2OH+O2
2(CH3)2CHCH2OH+O2![]() 2(CH3)2CHCHO+2H2O9
2(CH3)2CHCHO+2H2O9 、
、 CH3CH=CH2
CH3CH=CH2![]() CH3CH2CH2OH
CH3CH2CH2OH![]() CH3CH2CHO
CH3CH2CHO![]() CH3CH2COOH
CH3CH2COOH![]() CH3CH2COOCH2CH3
CH3CH2COOCH2CH3
【解析】
由合成路线及题中信息可知,A反应后得到B,则B为(CH3)2CHCH2OH;B氧化为C,C经氧化和酸化转化为D,则C为(CH3)2CHCHO,D为(CH3)2CHCOOH;F可以加聚为E,则F为![]() ;F经催化加氢得到G,结合M的分子式可知G为
;F经催化加氢得到G,结合M的分子式可知G为![]() ,M为
,M为![]() 。
。
(1)根据 以上分析,有机物B 为(CH3)2CHCH2OH,系统命名为2-甲基-1-丙醇,
故答案为:2-甲基-1-丙醇;
(2)F为![]() ,F中所含官能团的名称为醛基、碳碳双键;F经催化加氢得到G ,故F→G的反应类型为加成反应,
,F中所含官能团的名称为醛基、碳碳双键;F经催化加氢得到G ,故F→G的反应类型为加成反应,
故答案为:醛基、碳碳双键;加成反应;
(3)M为羧酸D((CH3)2CHCOOH)和醇G(![]() )发生酯化反应生成的酯,故M的结构简式为
)发生酯化反应生成的酯,故M的结构简式为![]() ,
,
故答案为:![]() ;
;
(4)B为(CH3)2CHCH2OH,C为(CH3)2CHCHO,B→C反应为醇的催化氧化反应,化学方程式为2(CH3)2CHCH2OH+O2![]() 2(CH3)2CHCHO+2H2O ,
2(CH3)2CHCHO+2H2O ,
故答案为:2(CH3)2CHCH2OH+O2![]() 2(CH3)2CHCHO+2H2O;
2(CH3)2CHCHO+2H2O;
(5)G为![]() ,X是G的同系物,且相对分子质量比G小14,则X的一种可能结构为
,X是G的同系物,且相对分子质量比G小14,则X的一种可能结构为![]() ,X有多种同分异构体,满足与FeCl3溶液反应显紫色的,说明含有酚羟基,除苯环外余下两个碳,可以是一个乙基,也可以是两个甲基:
,X有多种同分异构体,满足与FeCl3溶液反应显紫色的,说明含有酚羟基,除苯环外余下两个碳,可以是一个乙基,也可以是两个甲基:
①含有2个侧链,一个羟基和一个乙基,则乙基和羟基有邻、间、对3种结构;
②含有3个侧链,两个甲基和一个羟基,采用定一移一的方法,先找两个甲基有邻、间、对3种结构,邻二甲苯苯环上的氢被羟基取代有2种结构,间二甲苯苯环上的氢被羟基取代有3种结构,对二甲苯苯环上的氢被羟基取代只有1种结构,因此符合条件的X的同分异构体共有9种,其中核磁共振氢谱显示有4种不同化学环境的氢,且峰面积比为1∶1∶2∶6的结构简式为: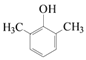 、
、 ,
,
故答案为:9 ; 、
、 ;
;
(6)参照M的合成路线,由丙烯和乙醇为起始原料制备丙酸乙酯,可以先由丙烯合成1-丙醇,然后把1-丙醇氧化为丙醛,接着把丙醛氧化为丙酸,最后由丙酸与乙醇发生酯化反应合成丙酸乙酯,合成路线如下:CH3CH=CH2![]() CH3CH2CH2OH
CH3CH2CH2OH![]() CH3CH2CHO
CH3CH2CHO![]() CH3CH2COOH
CH3CH2COOH![]() CH3CH2COOCH2CH3,
CH3CH2COOCH2CH3,
故答案为:CH3CH=CH2![]() CH3CH2CH2OH
CH3CH2CH2OH![]() CH3CH2CHO
CH3CH2CHO![]() CH3CH2COOH
CH3CH2COOH![]() CH3CH2COOCH2CH3。
CH3CH2COOCH2CH3。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子能在溶液中大量共存的是( )
A.Na+、Fe3+、SO42-、SCN-B.H+、Fe2+、SO42-、NO3-
C.Ca2+、Al3+、NO3-、Cl-D.K+、NH4+、CO32-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)常温时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH=3。则溶液中c(NH4+)+c(NH3·H2O)_______c (Al3+) + c[Al(OH)3](填“﹥”、“﹤”或“=”);2c(SO42-)- c(NH4+)-3c(Al3+)=________mol·L-1(填数值)。
(二)金属氢氧化物在酸中的溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下饱和溶液的浓度(mol·L1)如图所示。
(1)pH=3时溶液中铜元素的主要存在形式是________(填化学式)。

(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为______。
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,_____ (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是_______________________。
(4)要使氢氧化铜沉淀溶解,除加入酸外,还可以加入氨水,生成[Cu(NH3)4]2+,写出发生反应的离子方程式______________________。
(5)已知一些难溶物的溶度积常数如下表。
物质 | FeS | MnS | CuS |
Ksp | 6.3×1018 | 2.5×1013 | 1.3×1036 |
物质[] | PbS | HgS | ZnS |
Ksp | 3.4×1028 | 6.4×1053 | 1.6×1024 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的________(填字母)除去它们。
A.NaOH B.FeS C.Na2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在-100 ℃的低温下合成了一种烃X,此分子的结构如图所示(图中的连线表示化学键)。下列说法不正确的是

A. X不能使酸性KMnO4溶液褪色
B. X的性质与烯烃类似,容易发生加成反应
C. X在常温下不能稳定存在
D. 充分燃烧等质量的X和甲烷,X消耗氧气比甲烷少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1989年世界卫生组织把铝确定为食品污染源之一,而加以控制使用.铝在下列应用时应加以控制的是
①制铝合金 ②制电线 ③制炊具 ④银色漆颜料 ⑤明矾净水 ⑥明矾与苏打制食品膨松剂 ⑦易拉罐 ⑧用Al(OH)3凝胶制胃舒平药片 ⑨包装糖果和小食品
A. ③⑤⑧⑨ B. ⑥⑧⑨
C. ③⑤⑨ D. ③⑤⑥⑦⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X.Y.Z.M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子为偶数,室温下M单质为淡黄色固体,回答下列问题:
(1)Z元素是__________,写出Y2+离子的结构示意图_________________,写出单质Y与单质M反应生成物的电子式________________________。
(2)写出单质X与单质M在高温下反应的生成物的化学式为________,该产物分子为________形(填“直线”.平面三角等”),其化学键属________共价键(填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )

A. 一定条件下反应2SO2+O2![]() 2SO3达到平衡时,v正(O2)=2v逆(SO3)
2SO3达到平衡时,v正(O2)=2v逆(SO3)
B. 用如图所示方法可保护钢闸门不被腐蚀
C. 常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中 ![]() 的值增大
的值增大
D. 常温下,pH=2的HCl溶液与pH=12的Ba(OH)2溶液等体积混合,两者恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液X,由Na+、Ag+、Ba2+、Al3+、Fe3+、AlO2—、CO32—、SO42—中的若干种离子组成,取该溶液进行如下实验:

(1)气体B的成分是______________。
(2)写出步骤②形成白色沉淀甲的离子方程式__________________________。
(3)通过上述实验,可确定X溶液中一定存在的离子是_________________________,尚未确定是否存在的离子是__________________,只要设计一个简单的后续实验就可以确定该离子是否存在,该方法是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海水提取溴和镁的过程如下,下列说法不正确的是

A. 工业溴中含少量Cl2,可用NaOH溶液除去
B. 工业上常利用电解熔融MgCl2冶炼金属镁
C. 富集溴元素过程中,空气吹出法利用了溴易挥发的性质
D. 若提取1 mol Br2,至少需要标准状况下44.8 L的Cl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com