
【题目】兰州一中高一某化学兴趣小组需要0.10 mol/L的硫酸920mL,某同学欲用密度为1.84 g/cm![]() 、溶质的质量分数为98%的浓硫酸进行配制。试回答:
、溶质的质量分数为98%的浓硫酸进行配制。试回答:
(1)需量取98%浓硫酸的体积为_______mL。
(2)若提供如下仪器:
A. 量筒 B. 托盘天平 C. 玻璃棒 D. 容量瓶 E. 胶头滴管 F. 烧杯 G. 漏斗。 完成该实验不需选用的仪器是_______________(将仪器标号填在横线上)。
(3)下列操作会使所配制的溶液物质的量浓度一定偏低的是___________。
A.容量瓶使用前未干燥
B.用量筒量取所需体积的浓硫酸溶液时俯视
C.定容时观察液面俯视
D.定容时观察液面仰视
E.加蒸馏水时不慎超过了刻度线,立即用胶头滴管吸出
(4)下列关于容量瓶的使用方法中,正确的是__________________(填序号)。
A. 使用前要检验是否漏水
B. 在容量瓶中直接溶解固体或稀释液体
C. 溶液未经冷却即注入容量瓶中
D. 向容量瓶中转移溶液要用玻璃棒引流
【答案】 5.4 BG BDE AD
【解析】(1)现需要0.10 mol/L的硫酸920mL溶液,需要要配制1000mL的该溶液,又因稀释时溶质的物质的量不变,则0.10 mol/L×1L==V×1.84 g/cm-3×98%/98g/mol,V≈5.4mL。
(2)实验过程包括称量、溶解、转移、定容等,需要的仪器有量筒、玻璃棒、1000mL容量瓶、胶头滴管、烧杯,不需要的有托盘天平、漏斗。
(3)A.容量瓶使用前未干燥,无影响;B.用量筒量取所需体积的浓硫酸溶液时俯视,所量取硫酸体积偏小,所配溶液浓度偏低;C.定容时观察液面俯视,所加水的体积减小,所配溶液浓度偏高;D.定容时观察液面仰视,所加水的体积增大,所配溶液浓度偏低;E.加蒸馏水时不慎超过了刻度线,所加水的体积增大,所配溶液浓度偏低。
(4)使用容量瓶之前要检验它是否漏水;因容量瓶是比较精密的仪器,有温度与容量要求,不能直接在容量瓶中溶解、配制溶液,溶解后溶液需要冷却至室温后用玻璃棒引流转移到容量瓶中。故AD正确。


科目:高中化学 来源: 题型:
【题目】唐代《酉阳杂俎》中有“高奴县石脂水,水腻浮水上如漆,采以膏车及燃灯,极明”的记载,文中 “石酯水”指的是( )
A. 甘油 B. 乙醇 C. 石油 D. 醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. CS2为V形的极性分子
B. C1O3-的空间构型为平面三角形
C. SF6中所有原子均满足8电子稳定结构
D. SiF4和SO32-的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生产生活中用途广泛。利用FeSO4制备还原铁粉的工业流程如下:

实验室中可用FeSO4(用铁粉和稀硫酸反应制得)和NH4HCO3在如下装置模拟上述流程中的“转化”环节。
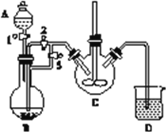
(1)装置A的名称是________,装置B中盛放的试剂是________,NH4HCO3盛放在装置________中。
(2)实验过程中,欲将生成的FeSO4溶液和NH4HCO3溶液混合制FeCO3沉淀,操作方法是________________,发生主要反应的离子方程式为_____________________。FeSO4溶液要现用现配制的原因是____________,检验久置的FeSO4是否变质的方法是______________。
(3)干燥过程主要目的是脱去游离水,过程中会有少量FeCO3在空气中被氧化为FeOOH,该反应的化学方程式为____________________________,取干燥后的FeCO3样品12.49 g,与碳混合后焙烧,最终得到还原铁粉6.16 g,计算样品中杂质FeOOH的质量:________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质混合后,没有明显现象的是( )
①H2S和SO2 ②SO2和SO3
③SO2和氯水 ④SO3(气)和Cl2
⑤H2S和SO3(气) ⑥H2S和Cl2
A. ①③⑥ B. ②④
C. ②⑤⑥ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如下所示,其中Z元素最外层电子数是其电子层数的2倍。请回答下列问题:
X | Y | |
Z | W |
(1)元素Z位于周期表中的位置 。
(2)实验室制取X元素的氢化物的化学方程式为 。
(3)W、Z的最高价氧化物对应的含氧酸的酸性大小顺序 (用化学式表示)。
(4)将W的单质通入含等物质的量FeBr2的溶液中,发生反应的离子方程式为 。
(5)Z和X形成的一种化合物相对分子质量在170~190之间,且Z的质量分数约为70%。该化合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,用0.1000mol/L NaOH溶液滴定25.00mL 0.1000mol/L某一元酸HX溶液,滴定过程中pH变化曲线如下图所示。下列说法不正确的是( )

A. 在A点:c(HX)>c(Na+)>c(X-)
B. 在B点,溶液中c(H+)=c(OH-)
C. C点溶液中存在的主要平衡是X- + H2O![]() HX+OH-
HX+OH-
D. 0.05mol/L NaX溶液的pH ≈ 9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某矿石(仅含两种元素)的组成和性质,设计并完成如下实验:
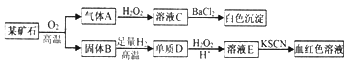
请回答:(1)某矿石的组成元素为__________(用元素符号表示)。
(2)气体A与H2O2溶液反应的化学方程式是________________。
(3)写出D→E的离子方程式____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com