
【题目】常温时,用0.1000mol/L NaOH溶液滴定25.00mL 0.1000mol/L某一元酸HX溶液,滴定过程中pH变化曲线如下图所示。下列说法不正确的是( )

A. 在A点:c(HX)>c(Na+)>c(X-)
B. 在B点,溶液中c(H+)=c(OH-)
C. C点溶液中存在的主要平衡是X- + H2O![]() HX+OH-
HX+OH-
D. 0.05mol/L NaX溶液的pH ≈ 9
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在恒定容积密闭容器中反应,下列选项中不能说明反应已达到平衡状态的是 ( )
2NO+O2在恒定容积密闭容器中反应,下列选项中不能说明反应已达到平衡状态的是 ( )
A. 单位时间内生成n mol O2的同时生成2n mol NO2
B. 反应容器内,物质的分子总数不随时间的变化而变化
C. 用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1
D. 混合气体的颜色不再改变的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兰州一中高一某化学兴趣小组需要0.10 mol/L的硫酸920mL,某同学欲用密度为1.84 g/cm![]() 、溶质的质量分数为98%的浓硫酸进行配制。试回答:
、溶质的质量分数为98%的浓硫酸进行配制。试回答:
(1)需量取98%浓硫酸的体积为_______mL。
(2)若提供如下仪器:
A. 量筒 B. 托盘天平 C. 玻璃棒 D. 容量瓶 E. 胶头滴管 F. 烧杯 G. 漏斗。 完成该实验不需选用的仪器是_______________(将仪器标号填在横线上)。
(3)下列操作会使所配制的溶液物质的量浓度一定偏低的是___________。
A.容量瓶使用前未干燥
B.用量筒量取所需体积的浓硫酸溶液时俯视
C.定容时观察液面俯视
D.定容时观察液面仰视
E.加蒸馏水时不慎超过了刻度线,立即用胶头滴管吸出
(4)下列关于容量瓶的使用方法中,正确的是__________________(填序号)。
A. 使用前要检验是否漏水
B. 在容量瓶中直接溶解固体或稀释液体
C. 溶液未经冷却即注入容量瓶中
D. 向容量瓶中转移溶液要用玻璃棒引流
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验:
甲同学向1 mol·L1氯化铁溶液中加入少量的NaOH溶液;
乙同学直接加热饱和FeCl3溶液;
丙同学向25 mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
(1)其中能得到Fe(OH)3胶体的同学是 。
(2)证明有Fe(OH)3胶体生成的实验操作是 。
(3)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明Fe(OH)3胶粒带 电荷(填“正”或“负”)。
②向其中加入饱和Na2SO4溶液,产生的现象是 。
(4)Fe(OH)3胶体能稳定存在的主要原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得),若1 mol水蒸气转化为液态水放出的热量为45kJ,则反应H2(g) +![]() O2(g) = H2O( l )的ΔH =________________kJ/mol。
O2(g) = H2O( l )的ΔH =________________kJ/mol。
(2)下图为氢氧燃料电池的结构示意图,当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:

①图中通过负载的电子流动方向_______ (填“向左”或“向右”). 负极发生_____________反应;
②写出氢氧燃料电池工作时电极反应式负极:________________________________,正极:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. N和As属于第ⅤA族元素,氮原子得电子能力比砷原子强
B. 族序数等于其周期序数的元素一定是金属元素
C. 元素周期表中,位于金属和非金属交界线附近的元素属于过渡元素
D. Si、S、Cl的最高价氧化物都能与水反应生成相应的酸,且酸性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示。下列说法正确的是
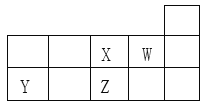
A. Y、Z、X三种元素的原子半径依次增大
B. X、Z都是第2周期VIA族元素,单质的氧化性X>Z
C. Y的气态氢化物的热稳定性比Z的高
D. R元素与W同族且相邻周期,则R元素最高价氧化物的水化物的酸性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,用煮沸过的蒸馏水溶解14gKOH配成250mL溶液,取出50mL溶液与CO2恰好完全反应(溶液体积变化忽略不计)。
(1)取出的50mLKOH溶液的pH=___________。
(2)若反应后溶液中c(CO32-)=c(HCO3-),则溶液中c(HCO3-)=_______mol·L-1(H2CO3忽略不计,计算结果保留2位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com