
【题目】一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( ) 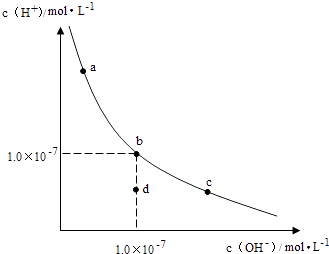
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10﹣13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
【答案】C
【解析】解:A、由图可知abc三点对应的平衡常数不变,故abc为等温线,故升高温度,不能由c到b,故A错误; B、b点c(H+)=c(OH﹣)=1.0×10﹣7 , 故KW=1.0×10﹣7×1.0×10﹣7=1.0×10﹣14 , 故B错误;
C、加入FeCl3 , 氯化铁为强酸弱碱盐,铁离子结合水电离出的氢氧根,促进水的电离平衡右移,即氢离子浓度增大,氢氧根离子浓度减小(由b到a),符合图象变化趋势,故C正确;
D、由c点到d点,水的离子积常数减小,温度不变,K不变,故不能利用稀释使其形成此变化,故D错误,
故选C.
A、由图可知abc为等温线;
B、由b点计算此温度下水的离子积常数为1.0×10﹣14;
C、b点到a点,氢离子浓度变大,氢氧根离子浓度减小,据此解答即可;
D、稀释不会引起水的离子积的改变,据此解答即可.


科目:高中化学 来源: 题型:
【题目】下图中的实验装置可用于制取乙炔。请填空:
(1)图中,A管的作用是。
制取乙炔的化学方程式是。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是 , 乙炔发生了反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是 , 乙炔发生了反应。
(4)为了安全,点燃乙炔前应 , 乙炔燃烧时的实验现象。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题
(1)KAl(SO4)2的电离方程式_______________________。
(2)向石蕊试液中通入氯气,起始时溶液变红,一段时间后溶液褪色,则使溶液变红和褪色的微粒分别是______________、_________________ (填微粒符号)。
(3)实验室用质量分数为36.5%,密度为1.19g·cm-3的浓盐酸来配制100ml,2mol/L的稀盐酸,需要用量筒量取_______________ml该浓盐酸。
(4)化学方程式H2S+H2SO4(浓)=SO2↑+S↓+2H2O,当生成4.48L(标况) SO2时,转移的电子是__________mol。
(5)下列四个图像中,横坐标表示加入物质的物质的量,纵坐标表示生成沉淀的量或产生气体的量,从A~D中选择符合各题要求的序号填人表中。
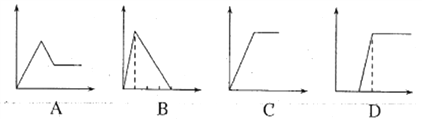
溶液 | 加入的物质 | 序号 |
①AlCl3溶液 | 通入过量的NH3 | ___ |
②Na2CO3和NaOH的溶液 | 滴入过量的盐酸 | ___ |
③NaAlO2溶液 | 滴加稀硫酸至过量 | ___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10﹣10 , 下列说法不正确的是( ) 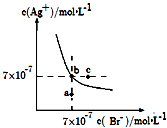
A.如图中a点对应的是AgBr的不饱和溶液
B.在t℃时,Ksp(AgBr)=4.9×10﹣13
C.在t℃时,AgCl(s)+Br﹣(aq)AgBr(s)+Cl﹣(aq)的平衡常数K≈816
D.在AgBr的饱和溶液中加入NaBr固体,可使溶液由b点到以c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二苯基乙二酮常用作医药中间体及紫外线固化剂,可由二苯基羟乙酮氧化制得,反应的化学方程式及装置图(部分装置省略)如下: 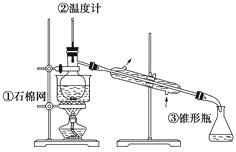
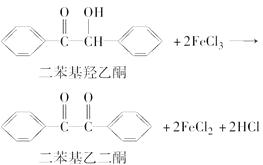
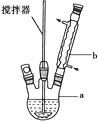
在反应装置中,加入原料及溶剂,搅拌下加热回流。反应结束后加水煮沸,冷却后即有二苯基乙二酮粗产品析出,用70%乙醇水溶液重结晶提纯。重结晶过程:
加热溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥
请回答以下问题:
(1)写出装置图中玻璃仪器的名称:
a , b。
(2)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体:。
A.缓慢冷却溶液 B.溶液浓度较高
C.溶质溶解度较小 D.缓慢蒸发溶剂
如果溶液发生过饱和现象,可采用、等方法促进晶体析出。
(3)抽滤所用的滤纸应略(填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。烧杯中的二苯
基乙二酮晶体转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是。
A.无水乙醇 B.饱和氯化钠溶液 C.70%乙醇水溶液 D.滤液
(4)上述重结晶过程中的哪一步操作除去了不溶性杂质:。
(5)某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始、回流15 min、30 min、45 min和60 min时,用毛细管取样、点样,薄层色谱展开后的斑点如下图所示。该实验条件下比较合适的回流时间是________。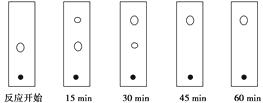
A.15 min
B.30 min
C.45 min
D.60 min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确前是
A. Cl2通入水中:C12+H2O![]() 2H++C1—+ClO—
2H++C1—+ClO—
B. 将铜丝插入浓硝酸中:Cu+4H++2NO3—==Cu2++2NO2↑+2H2O
C. 磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3—==3Fe3++NO↑+4H2O
D. (NH4)2Fe(SO4)2溶液与过量Ba(OH)2溶液混合:Fe2++2SO42—+2Ba2++2OH—=Fe(OH)2↓+2BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg ![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( ) 
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH﹣)相等
D.当lg ![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则 ![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国著名行业杂志《应用化学》上刊登文章介绍:某中德联合研究小组设计制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐作“瓶盖”,恰好可将一个水分子关在里面。下列说法正确的是( )
A.“水瓶”、双氧水、冰水混合物都是混合物
B.石墨和C60互称为同位素
C.磷酸钙是可溶性强电解质
D.一定条件下石墨转化为C60是化学变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com