
| A. | 标准状况下,33.6LHF中含有氟原子的数目为1.5NA | |
| B. | 17g-OH中电子数为9NA | |
| C. | 氢氧燃料电池正极消耗22.4 L气体时,电路中通过的电子数目为2NA | |
| D. | 标准状况下,0.1mol Cl2溶于水,转移电子数为0.1NA |
分析 A.标况下氢氟酸为液体;
B.1个-OH含有9个电子;
C.气体状况未知;
D.氯气和水反应是可逆反应不能进行彻底;
解答 解:A.标况下氢氟酸为液体,不能使用气体摩尔体积,故A错误;
B.17g-OH物质的量为$\frac{17g}{17g/mol}$=1mol,含有电子数为9NA,故B正确;
C.气体状况未知,气体摩尔体积不确定,无法计算气体的物质的量,故C错误;
D.氯气和水反应是可逆反应不能进行彻底,常温常压下,0.1mol Cl2完全溶于水转移电子数小于0.1NA,故D错误;
故选:B.
点评 本题考查了有关阿伏伽德罗常数的应用,注意掌握标况下的气体摩尔体积的使用条件,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量、物质的量浓度之间的关系,题目难度不大.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
| Na2O2/mol | NaHCO3/mol | 剩余固体成分 | |
| A | 1 | 2 | Na2CO3 |
| B | 1.5 | 2 | Na2O2Na2CO3 |
| C | 2 | 1 | Na2CO3、NaOH、Na2O2 |
| D | 2 | 2 | NaOH、Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制取气体常用的装置如图所示,请回答下列问题.(选用装置时填字母编号)实验室通常用如图所示的装置来制取氨气.回答下列问题:
实验室制取气体常用的装置如图所示,请回答下列问题.(选用装置时填字母编号)实验室通常用如图所示的装置来制取氨气.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 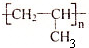 | B. |  | C. | 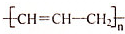 | D. | 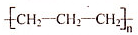 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温pH=3的硫酸与pH=11的LiOH溶液等体积混合溶液呈碱性,说明LiOH为强碱 | |
| B. | 用明矾净水是因为Al3+水解生成的Al(OH)3胶粒能凝聚水中的悬浮物 | |
| C. | 除去MgCl2溶液中的FeCl3,可向其中加入MgCO3 | |
| D. | 除去锅炉水垢中的CaSO4,可加入Na2CO3溶液将其转化为CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 硫代硫酸钠与稀硫酸反应的离子方程式为S2O32-+2H+═SO42-+S↓+H2O | |
| C. | 利用水解原理制备纳米材料TiCl4+(2+n)H2O?4HCl+TiO2?nH2O↓ | |
| D. | 向明矾溶液中滴加Ba(OH)2至SO42-恰好完全沉淀时Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
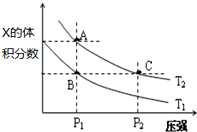 t℃时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
t℃时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.| t/min | X/mol | Y/mol | Z/mol |
| 0 | 2.00 | 4.00 | 0 |
| 1 | 1.80 | 3.60 | 0.40 |
| 3 | 1.65 | 3.30 | 0.70 |
| 5 | 1.55 | 3.10 | 0.90 |
| 14 | 1.00 | 2.00 | 2.00 |
| 16 | 1.00 | 2.00 | 2.00 |
| 20 | 0.50 | 4.24 | 3.00 |
| 22 | 0.50 | 4.24 | 3.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果盐酸的浓度是醋酸的两倍,则盐酸中的H+浓度也是醋酸中的两倍 | |
| B. | 将NaOH溶液和氨水各稀释一份,两者的OH-浓度均减小到原来的$\frac{1}{2}$ | |
| C. | 中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸 | |
| D. | 若电解质溶液的导电能力也可能比强电解质溶液的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCO2气体的质量为44g•mol-1 | |
| B. | 标准状况下,0.5mol水的体积为11.2L | |
| C. | 常温常压下,11.2 L氯气所含有的原子数目为NA | |
| D. | 同温同压下,相同物质的量的N2和CO所含的原子数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com