
【题目】工业上可用铬铁矿(主要成分可表示为FeO·Cr2O3,还含有Al2O3、MgCO3、SiO2等杂质)为原料制备重铬酸钾晶体和绿矾的流程如下:
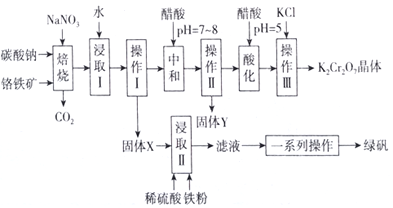
已知:Ⅰ.常见离子沉淀的pH范围
Fe3+ | Al3+ | Mg2+ | SiO32- | AlO2- | |
开始沉淀 | 1.9 | 4.2 | 8.1 | 9.5 | 10.2 |
沉淀完全 | 3.2 | 5.3 | 9.4 | 8.0 | 8.5 |
Ⅱ.焙烧过程中主要发生反应:2FeO·Cr2O3+4Na2CO3+7NaNO3=4Na2Cr2O4+Fe2O3+4CO2↑+7NaNO2。
(1)绿矾的化学式为________。
(2)焙烧后的混合物中除含有Na2Cr2O4、NaNO2和过量的Na2CO3、NaNO3外,还含有NaAlO2和Na2SiO3等物质,则焙烧过程中NaAlO2的化学方程式为___________________________。
(3)固体Y的主要成分为________(填写化学式)。
(4)酸化过程中用醋酸调节pH=5的目的为________________________;若pH调节的过低,NO2-可被氧化为NO3-,其离子方程式为_________________________________。
(5)调节pH=5后,加入KCl控制一定条件,可析出K2Cr2O7晶体,说明溶解度的大小:K2Cr2O7________Na2Cr2O7(填“大于”或“小于”)。
(6)流程中的一系列操作为____________________________________。
【答案】 FeSO4·7H2O Na2CO3+Al2O3![]() 2NaAlO2+CO2↑ H2SiO3和Al(OH)3 将CrO42-转化为Cr2O72- Cr2O72-+3NO2-+8H+=2Cr3++3NO3-+4H2O 小于 蒸发浓缩、冷却结晶、过滤
2NaAlO2+CO2↑ H2SiO3和Al(OH)3 将CrO42-转化为Cr2O72- Cr2O72-+3NO2-+8H+=2Cr3++3NO3-+4H2O 小于 蒸发浓缩、冷却结晶、过滤
【解析】(1). 绿矾的化学式为FeSO4·7H2O,故答案为:FeSO4·7H2O;
(2). 焙烧过程中,Na2CO3和Al2O3反应生成NaAlO2和CO2,化学方程式为:Na2CO3+Al2O3![]() 2NaAlO2+CO2↑,故答案为:Na2CO3+Al2O3
2NaAlO2+CO2↑,故答案为:Na2CO3+Al2O3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
(3). 由离子沉淀的pH范围可知,调节pH=7~8,是为了沉淀H2SiO3和Al(OH)3,所以固体Y的主要成分是H2SiO3和Al(OH)3,故答案为:H2SiO3和Al(OH)3;
(4). 由流程图可知,在酸化过程中用醋酸调节pH=5的目的是将CrO42-转化为Cr2O72-,若pH调节的过低,NO2-可被Cr2O72-氧化为NO3-,离子方程式为:Cr2O72-+3NO2-+8H+=2Cr3++3NO3-+4H2O,故答案为:将CrO42-转化为Cr2O72-;Cr2O72-+3NO2-+8H+=2Cr3++3NO3-+4H2O;
(5). 调节pH=5后,加入KCl控制一定条件,可析出K2Cr2O7晶体,说明在该条件下K2Cr2O7的溶解度最小,故答案为:小于;
(6). 所得滤液为硫酸亚铁溶液,从滤液中得到绿矾晶体的方法为:蒸发浓缩、冷却结晶、过滤,故答案为:蒸发浓缩、冷却结晶、过滤。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D 为原子序数依次增大的四种元素,A2和 B+具有相同的电子构型;C、D 为同周期元素,C 核外电子总数是最外层电子数的 3 倍;D 元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是_____(填元素符号),其中 C 原子的外围电子排布图为_____.
(2)单质 A 有两种同素异形体,其中沸点高的是_________(填分子式),原因是_____;A 和 B 的氢化 物所含的化学键类型分别为_____和_____.
(3)C 和 D 反应可生成组成比为 1:3 的化合物 E,E 的立体构型为_____,中心原子的杂化轨 道类型为_____.
(4)化合物 D2A 的立体构型为_____,中心原子的价层电子对数为_____,单质 D与湿润的 Na2CO3 反应可制备 D2A,其化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知p(A)=-lgc(A),三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
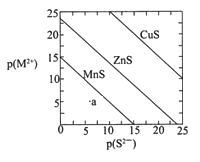
A. a点无MnS沉淀生成
B. CuS和MnS的悬浊液中,c(Cu2+)/c(Mn2+)=10-20
C. 向MnS悬浊液中加入少量CuCl2固体,c(Mn2+) 减小
D. 向含等浓度ZnCl2 和CuCl2的溶液中逐滴加入饱和Na2S溶液,先析出的是ZnS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中信息判断,下列选项正确的是 ( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+… |
A. 第①组反应的其余产物只有O2
B. 第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C. 第③组反应中生成1 mol Cl2,转移电子10 mol
D. 氧化性由强到弱顺序为MnO![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组在实验室用制备的氯气与一氧化氮在常温常压下合成亚硝酰氯。
【查阅资料】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,液体状态呈红褐色,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。对眼睛、皮肤和粘膜有强烈刺激性,具有类似氯气和氮氧化物的毒作用。冰水中加入NaCl可降低温度。
【原料制备】在实验室分别制备原料气NO和Cl2。
(1)用如下装置制备纯净干燥的气体,请补充下表中各仪器中的试剂_______。
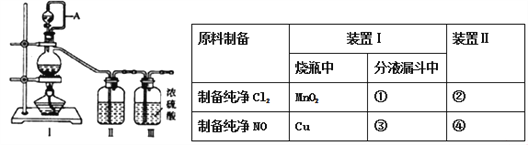
【合成亚硝酰氯】利用制得的NO和Cl2制备NOCl,装置如图所示:
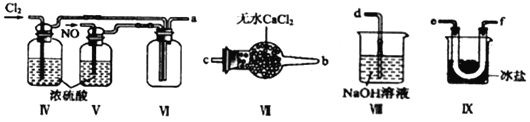
(2)装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是___________________。
(3)装置连顺序为a→_______________(按气流自左向右方向,用小写字母表示)。
(4)装置Ⅶ的作用是___________________________________。
(5)装置Ⅸ在实验时,预期观察到的现象是__________________________________。
(6)装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________________。
【拓展学习】
(7)查阅资料,得知配制王水(浓硝酸与浓盐酸的混酸)时会生成亚硝酰氯和氯气,该反应的化学方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 X、Y、Z、W均为短周期元素,他们在元素周期表的位置如下图所示。若Y原子的最外层电子数与电子总数之比为3:4,下列说法正确的是

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 气态氢化物的稳定性:Z>W
D. W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. 氯化钠的电子式:![]() B. 氯原子的结构示意图:
B. 氯原子的结构示意图:![]()
C. 乙烯的结构简式:CH2CH2 D. 质子数为35、中子数为45的溴原子: ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com