
【题目】在某温度下,将H2和I2各1 mol的气态混合物充入1 L的密闭容器中,发生反应:H2(g)+I2(g)![]() 2HI(g) ΔH<0; 5 min后达到平衡状态,测得c(H2)=0.9 mol·L-1,则下列结论中,不能成立的是
2HI(g) ΔH<0; 5 min后达到平衡状态,测得c(H2)=0.9 mol·L-1,则下列结论中,不能成立的是
A. 平衡时H2、I2的转化率相等
B. 若将容器温度提高,其平衡常数K一定增大
C. 其他条件不变再向容器中充入少量H2,I2的转化率提高
D. 从反应开始至平衡的过程中,v(HI)=0.04 mol·L-1·min-1
科目:高中化学 来源: 题型:
【题目】用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的是( )
A. 20 mL 2 mol/L FeCl3溶液 B. 40 mL 1 mol/L NaHCO3溶液
C. 20 mL 1 mol/L Na2SO3溶液 D. 40 mL 2 mol/L NH4HCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1L0.1mol/L的 NaHSO4溶液中所含的氧原子数目为0.4NA
B. 1mol-OH(羟基)与1 mol H3O+中所含的电子数均为10NA
C. 7.1gCl2与足量Fe充分反应,转移的电子数为0.2NA
D. 80gCuO和Cu2S的混合物中,所含铜原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO4![]() 6H2O易溶于水,其溶解度随温度升高明显增大。以电镀废渣(主要成分是NiO,还有CuO、FeO等少量杂质)为原料制备该晶体的流程如下,下列说法错误的是
6H2O易溶于水,其溶解度随温度升高明显增大。以电镀废渣(主要成分是NiO,还有CuO、FeO等少量杂质)为原料制备该晶体的流程如下,下列说法错误的是
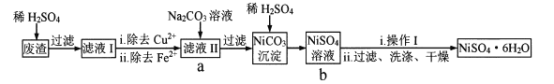
A. 溶解废渣时不能用稀盐酸代替稀H2SO4B. 除去Cu2+可采用FeS
C. 流程中a-b的目的是富集NiSO4D. “操作I”为蒸发浓缩、冷却结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2+O2![]() 2SO3是工业制硫酸的一步重要反应,下列说法正确的是
2SO3是工业制硫酸的一步重要反应,下列说法正确的是
A. 使用催化剂能改变该反应限度
B. 减小SO2的浓度能加快该反应的速率
C. 升高体系温度能加快反应速率
D. 1 mol SO2和足量的O2在一定条件下充分反应,生成1 mol SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度均为 0.1 molL-1、体积均为 100 mL 的两种一元酸 HX、HY的溶液中,分别加入 NaOH固体,lg[c(H+ )/c(OH- )]随加入 NaOH的物质的量的变化如图所示。下列说法正确的是

A. 常温下电离常数:HX < HY![]()
B. a 点由水电离出的 c(H+)=10-12 molL-1
C. c 点溶液中:c(Y- )>c(HY )![]()
D. b 点时酸碱恰好完全中和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在定温定容下的反应:2AB(g)![]() 3A2(g)+B2(g),能说明此反应达到平衡是
3A2(g)+B2(g),能说明此反应达到平衡是
A.混合气体的平均摩尔质量不再随时间的变化而变化
B.混合气体的密度不再随时间的变化而变化
C.AB的消耗速率等于A2的消耗速率
D.单位时间内生成3nmolA2,同时消耗2nmolAB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理利用或转化NO2、SO2、CO、NO等污染性气体是人们共同关注的课题。
Ⅰ.某化学课外小组查阅资料后得知:2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
N2O2(g)(快) v1正=k1正·c2(NO),v1逆=k1逆·c(N2O2) H1<0
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
2NO2(g)(慢) v2正=k2正·c(N2O2)·c(O2),v2逆=k2逆·c2(NO2) H2<0
请回答下列问题:

(1)反应2NO(g)+O2(g)![]() 2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的H=________________(用含H1和H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
2NO2(g)达到平衡状态,写出用k1正、k1逆、k2正、k2逆表示平衡常数的表达式K=_____________________。
(2)决定2NO(g)+O2(g)![]() 2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
2NO2(g)反应速率是反应②,反应①的活化能E1与反应②的活化能E2的大小关系为E1________E2(填“>”、“<”或“=”)。
Ⅱ.(3)反应N2O4(g)![]() 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2(NO2)。其中k1、k2是与温度有关的常数。一定温度下,相应的速率与压强关系如图所示,在图中标出的点中,能表示该反应达到平衡状态的两个点是_______________,理由是__________________________________________________________________________________________。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1 HCl溶液等体积混合后溶液恰好呈中性(忽略溶液混合后体积的变化),用含a的表达式表示250C时NH3·H2O的电离常数Kb=_________________。用质量分数为17%,密度为0.93 g/cm3的氨水,配制200 mL a mol·L-1的氨水溶液,所需原氨水的体积V=___________mL。
(5)如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。物质A的化学式为_________,阴极的电极反应式是__________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图(A)处通入Cl2,当关闭(B)阀时,(C)处的湿润的红布条没有明显变化,当打开(B)阀时,(C)处的湿润红布条逐渐褪色,则(D)瓶中装的溶液是( )

A.浓硫酸B.NaOH溶液C.水D.NaCl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com