
A.B.C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图(反应条件和部分产物略去)。试回答:
(1)E的电子式是 。
(2)单质X和B或D均能反应生成黑色固体Y,Y的化学式是 。
(3)物质Z常用于对空气进行杀菌.净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是 。
(4)取0.3 mol F与足量D充分混合后,所得溶液中再通入0.2mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+) 。
(5)E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是 。(已知甲醇的燃烧热△H= -726.5kJ·mol-1,氢气的燃烧热△H= -285.8kJ·mol-1)
科目:高中化学 来源: 题型:
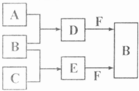 A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图(反应条件和部分产物略去).试回答:
A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图(反应条件和部分产物略去).试回答:



查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙、丙三种常见单质,A、B、C是三种常见的化合物,A为淡黄色固体;它们之间的转化关系如图所示.请填写下列空白:
甲、乙、丙三种常见单质,A、B、C是三种常见的化合物,A为淡黄色固体;它们之间的转化关系如图所示.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
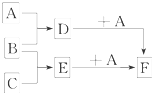 已知A、B、C是三种常见的单质,其中A为固体,B、C为气体;D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色;B和C反应时可观察到苍白色火焰,其产物极易溶于水得无色溶液E.它们之间转化关系如图所示.
已知A、B、C是三种常见的单质,其中A为固体,B、C为气体;D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色;B和C反应时可观察到苍白色火焰,其产物极易溶于水得无色溶液E.它们之间转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
 试回答:
试回答:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com