
����Ŀ��Ϊ�˽����������ơ�̼����泥����ȶ��������ֽ����ɰ�����������̼��ˮ�����Ȼ����ᴿ��ijͬѧ��Ƶ�ʵ��������ͼ��
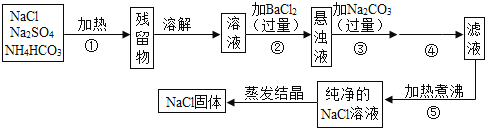
�Իش��������⣺
��1�������ٵ�Ŀ����_______���������ܷ������ᱵ��Һ��________����ܡ�����
��2�����в����ں�����ж�SO42-�ѳ�����������_______��
��3��д���������йصĻ�ѧ��Ӧ����ʽ_______�������ܵ�������_______��
��4������Ʒ����Ƿ����ܣ�˵������________��
��5��ԭ������Ʒ�к�NaClm1g�����õ���NaCl����m2g����m1_______m2�����������������������
���𰸡���ȥ̼����� �� ���ã����ϲ����Һ�еμ�BaCl2��Һ�����û�а�ɫ������������SO42-�ѳ�������ȡ�����ϲ������Һ���ٵμ�BaCl2��Һ��������������˵��SO42-�ѳ����� BaCl2+Na2CO3��BaCO3��+2NaCl ���� �����ܣ�����������Ĺ���Na2CO3û�г�ȥ ��
��������
������ʱ��������Լ��������������Ҫ�����ܿ��Ƽ����������ó����Լ�����̫�࣬��Ϊ�����ij����Լ��ֽ���Ϊ���ʣ���Ҫ�ٴν��д��������⣬����ij����Լ��в����������ӷ�Ӧ�����ӣ�Ӧ��ԭ��Һ������������ͬ��
��1����Ϊ̼����������ֽ⣬�ҷֽ����Ϊ�������壬���Բ����ٵ�Ŀ���dz�ȥ̼����泥������ڲ��������ᱵ��Һ����Ϊ������NO3-��
��Ϊ����ȥ̼����泥���
��2�����в����ں��ж�SO42-�ѳ����ķ����Ǿ��ã����ϲ����Һ�еμ�BaCl2��Һ�����û�а�ɫ������������SO42-�ѳ�������ȡ�����ϲ������Һ���ٵμ�BaCl2��Һ��������������˵��SO42-�ѳ�������
��Ϊ�����ã����ϲ����Һ�еμ�BaCl2��Һ�����û�а�ɫ������������SO42-�ѳ�������ȡ�����ϲ������Һ���ٵμ�BaCl2��Һ��������������˵��SO42-�ѳ�������
��3���������йصĻ�ѧ��Ӧ����ʽΪBaCl2+Na2CO3��BaCO3��+2NaCl�������ܵ������ǹ��ˣ�
��Ϊ��BaCl2+Na2CO3��BaCO3��+2NaCl�����ˡ�
��4������Ʒ����������ܣ���Ϊ����������Ĺ���Na2CO3û�г�ȥ��
��Ϊ�������ܣ�����������Ĺ���Na2CO3û�г�ȥ��
��5��ԭ������Ʒ�к�NaClm1g�����õ���NaCl����m2g���ڳ��ӹ����У��Ի��Һ�����˹��ˡ�ϴ�ӣ�����һ����NaCl��ʧ������m1��m2��
��������


 ������ÿ�ʱ�Ż���ҵϵ�д�
������ÿ�ʱ�Ż���ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϡ���ᡢ����ʯ��ˮ���Ȼ�ͭ��Һ����ѧ��ѧ�г������ʣ��������ʼ�ķ�Ӧ��ϵ��ͼ��ʾ��ͼ����Բ�ཻ����(A��B��C��D)��ʾ���ʼ�ķ�Ӧ�����ж�Ӧ�����ӷ���ʽ��д��ȷ����

A. OH+HCl=H2O+ClB. Ca(OH)2+Cu2+=Ca2++Cu(OH)2
C. Fe+Cu2+=Cu+Fe2+D. Fe+2H+=Fe3++H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��ѧ��ӦA2(g)��2B2(g)===2AB2(g)(AB2�ķ��ӽṹΪB��A��B)�������仯��ͼ��ʾ�������й���������ȷ���ǣ�

A. �÷�Ӧ�Ľ���һ����Ҫ����
B. �÷�Ӧ�Ħ�H����(E1��E2) kJ��mol��1
C. ����1 mol A��A����2 mol B��B�����ų�E1 kJ����
D. �÷�Ӧ�У���Ӧ��ļ����ܺʹ���������ļ����ܺ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����̷��¼���һ����ȫ������Ҫ���̷��к����ж��������谷�����й��������谷���ӵ�˵������ȷ���ǣ� ��
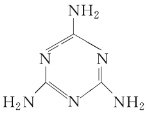
A. ���е�ԭ�Ӿ���ȡsp3�ӻ�
B. һ�������谷�����й�����15������
C. �����谷�ķ���ʽΪC3N3H6
D. �����谷������ͬʱ���м��Լ��ͷǼ��Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���ѧ�о��ɹ�������ͭ��������(CuMn2O4)���ڳ����´����������е�һ����̼�ͼ�ȩ(HCHO)��
(1)��һ�����ʵ���Ũ�ȵ�Cu(NO3)2��Mn(NO3)2��Һ�м���Na2CO3��Һ�����ó������������գ����Ƶ�CuMn2O4��
��д����̬Mnԭ�ӵļ۵����Ų�ʽΪ___________________________����Ԫ�����ڱ��У���Ԫ����________(����s����p����d����f������ds��)������Mnͬ���ڵ����й���Ԫ�صĻ�̬ԭ���У�������������Mn��ͬ��Ԫ����__________�֡�
��CO32-�Ŀռ乹����__________________(����������)��
(2)��ͭ��������Ĵ��£�CO������ΪCO2��HCHO������ΪCO2��H2O��
�ٸ��ݵȵ�����ԭ����CO���ӵĽṹʽΪ___________________________________��
��CO2������Cԭ�ӹ�����ӻ�����Ϊ________________________________________��
��1 mol��ȩ(HCHO)�����к��е�������ĿΪ__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������25 mL 2 mol��L��1Na2CO3��75 mL 1 mol��L��1��ϡ�������Na2CO3��Һ�����ε�ϡ������ ����ϡ���Ỻ���ε�Na2CO3��Һ�У��ڱ�״���²��������������( )
A.��Ϊ0.84 L
B.��Ϊ0.56 L
C.������
D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(SrSO4)��ˮ�еij����ܽ�ƽ����������ͼ��

����˵����ȷ���ǣ�������
A. 313Kʱ�������������֪Ksp(SrSO4) ������Ϊ10-5
B. ������ͬ�¶��У�313 KʱKsp(SrSO4)���
C. 283 Kʱ��ͼ��a���Ӧ����Һ�DZ�����Һ
D. 283 K�µ�SrSO4������Һ���µ�363 K���Ϊ��������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����Ҫ�Ļ����м��壬������ҵ�о����ȵ㡣һ���Ը����̿�(��Ҫ�ɷ�Ϊ���̻����PFeS)Ϊԭ���Ʊ������̵Ĺ����������£�

��֪��
������ϱ�������������MnSO4��Fe2O3������FeO��Al2O3��MgO��
�ڽ���������ˮ��Һ�е�ƽ��Ũ����pH�Ĺ�ϵ��ͼ��ʾ(25��)��
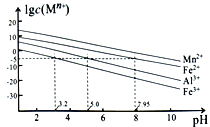
�۴�ʵ��������Mn2+��ʼ������pHΪ7.54������Ũ����10��5mol��L��1ʱ�����ӳ�����ȫ��
��ش�
��1����ͳ���մ��������̿�ʱ����������ϱ�����������ֱ����H2SO4��������ȱ��Ϊ________��
��2����������ʱ��������Ӧ�����ӷ���ʽΪ_________________________����ʡ�������������裬��ɵĺ����_________________________��
��3�����кͳ�����ʱ�����ɳ�������Ҫ�ɷ�Ϊ______________________(�ѧʽ)��
��4��������������ʱ����ʹ��Һ�е�Mg2+��Ca2+������ȫ����ά��c(F��)������___________��(��֪��Ksp(MgF2)=6.4��10��10��Ksp(CaF2)=3.6��10��12)
��5����ϵ�в�����ָ___________�����ˡ�ϴ�ӡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z����Ԫ�ص�ԭ������������������Yԭ�ӵ�L���Ӳ��У��ɶԵ�����δ�ɶԵ���ռ�ݵĹ������ȣ����չ����Xԭ�ӵ�L���Ӳ���δ�ɶԵ�������Y��ͬ�������пչ����W��Z ��ԭ���������10����Zԭ�ӵĵ�һ��������ͬ��������͡�
(1)д������Ԫ�ص�Ԫ�ط��ţ�W____��X____��Y____��Z____��
(2)XY�����У�Xԭ����Yԭ�Ӷ��ﵽ8�����ȶ��ṹ����XY������X��Yԭ�����ڳɼ��ĵ�����Ŀ�ֱ���____�����ݵ������ص���ʽ�IJ�ͬ�������ﹲ�ۼ�����Ҫ������____��
(3)XY2��ZYW��Ӧʱ��ͨ�����Ʒ�Ӧ������ʵ���֮�ȣ����Եõ���ͬ�IJ����ͬ�����£���ˮ���ܽ�Ƚ�С�IJ�����________(д��ѧʽ)��
(4)д��Z2Y2�ĵ���ʽ��____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com