
【题目】W、X、Y、Z四种元素的原子序数依次增大。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z 的原子序数相差10,且Z原子的第一电离能在同周期中最低。
(1)写出下列元素的元素符号:W____,X____,Y____,Z____。
(2)XY分子中,X原子与Y原子都达到8电子稳定结构,则XY分子中X和Y原子用于成键的电子数目分别是____;根据电子云重叠方式的不同,分子里共价键的主要类型有____。
(3)XY2与ZYW反应时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是________(写化学式)。
(4)写出Z2Y2的电子式:____________。
【答案】H C O Na 2和4 σ键,π键 NaHCO3 ![]()
【解析】
W、X、Y、Z四种元素的原子序数依次增大。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道,则Y原子核外电子排布为1s22s22p4,Y为氧元素;X原子的L电子层中未成对电子数与Y相同,但还有空轨道,则X原子核外电子排布为1s22s22p2,X为碳元素;W、Z的原子序数相差10,Z的原子序数大于氧元素,则Z一定处于第三周期,且Z原子的第一电离能在同周期中最低,则Z为Na元素,故W为氢元素,据此分析解答。
(1)由上述分析可知,W为H、X为C、Y为O、Z为Na,故答案为:H;C;O;Na;
(2)XY分子为CO,X原子与Y原子都达到8电子稳定结构,CO中C原子与O之间形成三个共用电子对,各含有1对孤对电子,其结构式为C≡O,叁键中有1个σ键和2个π键,其中有一个π键是由氧原子单方提供了2个电子形成的,故CO分子中C和O原子用于成键的电子数目分别是2和4;根据电子云重叠方式的不同,分子里共价键的主要类型有σ键、π键,故答案为:2和4;σ键、π键;
(3)CO2与NaOH反应时,通过控制反应物的物质的量之比,可以得到碳酸钠、碳酸氢钠,相同条件下,在水中溶解度较小的是NaHCO3,故答案为:NaHCO3;
(4)Z2Y2 为Na2O2,为离子化合物,钠离子和过氧根离子以离子键相结合,O与O以非极性共价键相结合,电子式为:![]() ,故答案为:
,故答案为:![]() 。
。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】为了将混有硫酸钠、碳酸氢铵(不稳定,受热易分解生成氨气、二氧化碳和水)的氯化钠提纯,某同学设计的实验流程如图:
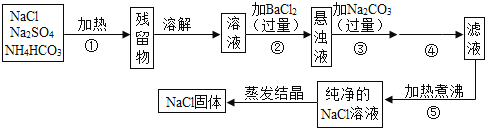
试回答下列问题:
(1)操作①的目的是_______。操作②能否用硝酸钡溶液?________(填“能”或“否”)。
(2)进行操作②后,如何判断SO42-已除尽,方法是_______。
(3)写出操作③有关的化学反应方程式_______。操作④的名称是_______。
(4)此设计方案是否严密,说明理由________。
(5)原固体样品中含NaClm1g,最后得到的NaCl固体m2g,则m1_______m2(填“>”、“<”或“﹦”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)光束通过Fe(OH)3胶体,可看到光亮的通路,这种现象叫________;
(2)19g某二价金属的氯化物ACl2中含有0.4mol Cl-离子,求ACl2的摩尔质量________
(3)在标准状况下,测得4.2g气体A的体积是3360mL,则A可能是什么气体________
(4)在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:CO2和CO的体积之比是________。
(5)在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。所得盐酸物质的量浓度分别是________
(6)现有以下物质:①NaCl晶体 ②盐酸 ③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜 ⑦CO2 ⑧浓H2SO4 ⑨KOH固体;以上物质中属于电解质的是________
(7)Ca(HCO3)2溶液与少量氢氧化钠溶液混合的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2O黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。种制取Cl2O 的装置如图所示。

已知:C12O的熔点为-116℃,沸点为3.8℃,Cl2 的沸点为-34.6℃;HgO+2Cl2=HgCl2 +Cl2O
下列说法不正确的是
A. 装置②、③中盛装的试剂依次是饱和食盐水和浓硫酸
B. 通入干燥空气的目的是将生成的Cl2O稀释减少爆炸危险
C. 从装置⑤中逸出气体的主要成分是Cl2O
D. 装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,元素A有可变化合价。它们之间存在如下图的所示的转化关系。由此推断:

(1)甲的化学式为_____________,丙的化学式为______________。
(2)写出甲和D反应的化学方程式___________________________________________。
(3)为检验化合物甲中元素的化合价,需要用到的药品有_________________________。
A.稀硫酸 B.盐酸 C.硫氰化钾溶液 D.高锰酸钾溶液
(4)为测定A和乙高温反应后所得固体中化合物甲的质量分数。取反应后所得固体并设计以下实验:
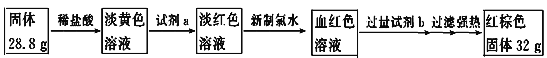
化合物甲的质量分数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
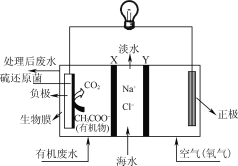
A. 该装置可以在高温下工作
B. X、Y依次为阳离子、阴离子选择性交换膜
C. 负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D. 该装置工作时,电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七叶树内酯的结构如下图,若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
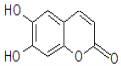
A. 2molBr2、2molNaOHB. 2molBr2、3molNaOH
C. 3molBr2、4molNaOHD. 4molBr2、4molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的甲烷和Cl2,用光照射一段时间后
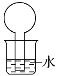
A. 只能生成CH3Cl一种有机物
B. 烧瓶内液面不可能上升
C. 烧瓶内的液体可能会分层
D. 向水中加入石蕊试液后无变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸广泛应用在稀有金属的湿法冶金、漂染工业、金属加工、无机药品及有机药物的生产等领域中。
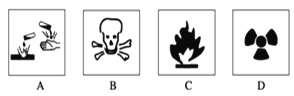
Ⅰ.(1)在盛放浓硫酸的试剂瓶的标签上应印有图警示标志中的____________。
(2)用12.0mol/L浓硫酸配制230mL 0.3mol/L的稀硫酸,需要用量筒量取浓硫酸的体积为______。
(3)溶液配制过程中需要的玻璃仪器除了烧杯、玻璃棒、量筒,还有____________________。
(4)溶液稀释过程中有以下操作:
a.量取浓硫酸和一定体积的水,在烧杯中稀释;
b.计算所需浓硫酸的体积;
c.上下颠倒摇匀;
d.加蒸馏水至刻度线1-2cm地方,改用胶头滴管加蒸馏水至凹液面与刻度线相切;
e.将稀释液转移入容量瓶,洗涤烧杯和玻璃棒,并将洗涤液转移入容量瓶,振荡;
以上正确的操作顺序为__________________________
(5)实验过程中的以下操作会导致最终所配溶液浓度(填“偏大”、“偏小”或“不变”)
a.量取浓硫酸时俯视:__________ 。
b.量取浓硫酸后,清洗了量筒并将洗涤液转移入容量瓶:__________ 。
c.实验前,容量瓶中有少量残留蒸馏水:__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com