
����Ŀ��Ũ����㷺Ӧ����ϡ�н�����ʪ��ұ��ƯȾ��ҵ�������ӹ�����ҩƷ���л�ҩ��������������С�
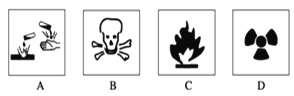
��.(1)��ʢ��Ũ������Լ�ƿ�ı�ǩ��Ӧӡ��ͼ��ʾ��־�е�____________��
(2)��12.0mol/LŨ��������230mL 0.3mol/L��ϡ���ᣬ��Ҫ����Ͳ��ȡŨ��������Ϊ______��
(3)��Һ���ƹ�������Ҫ�IJ������������ձ�������������Ͳ������____________________��
(4)��Һϡ�����������²�����
a����ȡŨ�����һ�������ˮ�����ձ���ϡ�ͣ�
b����������Ũ����������
c�����µߵ�ҡ�ȣ�
d��������ˮ���̶���1-2cm�ط������ý�ͷ�ιܼ�����ˮ����Һ����̶������У�
e����ϡ��Һת��������ƿ��ϴ���ձ��Ͳ�����������ϴ��Һת��������ƿ����
������ȷ�IJ���˳��Ϊ__________________________
(5)ʵ������е����²����ᵼ������������ҺŨ�ȣ�����ƫ��������ƫС��������������
a����ȡŨ����ʱ���ӣ�__________ ��
b����ȡŨ�������ϴ����Ͳ����ϴ��Һת��������ƿ��__________ ��
c��ʵ��ǰ������ƿ����������������ˮ��__________
���𰸡�A 6.3mL 250mL����ƿ����ͷ�ι� b��a��e��d��c ƫ�� ƫ�� ����
��������
��.(1)Ũ�����н�ǿ�ĸ�ʴ�ԣ�
(2) ����230mL 0.3mol/L��ϡ���ᣬӦѡ��250mL������ƿ������V1=![]() ���㣻
���㣻
(3)��Һ���ƹ�������Ҫ��Ͳ���ձ�����������250mL����ƿ����ͷ�ιܣ�
(4)��Һ���ƹ�������Ϊ�����㡢��ȡ��ϡ�͡���ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȣ�
(5) a����ȡŨ����ʱ���ӣ�����Ũ��������ƫС�����ʵ����ʵ���ƫС����Ũ��ƫ�ͣ�
b����ȡŨ�������ϴ����Ͳ����ϴ��Һת��������ƿ������Ũ��������ʵ���ƫ����Ũ��ƫ�ߣ�
c��ʵ��ǰ������ƿ����������������ˮ������Һ�е����ʼ��ܼ�����Ӱ�죬��Ũ�Ȳ��䡣
��.(1)Ũ�����н�ǿ�ĸ�ʴ�ԣ�Ӧ����A��ͼʾ��
(2) ����230mL 0.3mol/L��ϡ���ᣬӦѡ��250mL������ƿ����V1=![]() =
=![]() =6.25mL������Ͳ��ȡ6.3mL��
=6.25mL������Ͳ��ȡ6.3mL��
(3)��Һ���ƹ�������Ҫ��Ͳ���ձ�����������250mL����ƿ����ͷ�ιܣ�
(4)��Һ���ƹ�������Ϊ�����㡢��ȡ��ϡ�͡���ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȣ���˳��Ϊb��a��e��d��c��
(5) a����ȡŨ����ʱ���ӣ�����Ũ��������ƫС�����ʵ����ʵ���ƫС����Ũ��ƫ�ͣ�
b����ȡŨ�������ϴ����Ͳ����ϴ��Һת��������ƿ������Ũ��������ʵ���ƫ����Ũ��ƫ�ߣ�
c��ʵ��ǰ������ƿ����������������ˮ������Һ�е����ʼ��ܼ�����Ӱ�죬��Ũ�Ȳ��䡣


 ������ҵ��ͬ����ϰ��ϵ�д�
������ҵ��ͬ����ϰ��ϵ�д� С��ſ�ʱ��ҵϵ�д�
С��ſ�ʱ��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z����Ԫ�ص�ԭ������������������Yԭ�ӵ�L���Ӳ��У��ɶԵ�����δ�ɶԵ���ռ�ݵĹ������ȣ����չ����Xԭ�ӵ�L���Ӳ���δ�ɶԵ�������Y��ͬ�������пչ����W��Z ��ԭ���������10����Zԭ�ӵĵ�һ��������ͬ��������͡�
(1)д������Ԫ�ص�Ԫ�ط��ţ�W____��X____��Y____��Z____��
(2)XY�����У�Xԭ����Yԭ�Ӷ��ﵽ8�����ȶ��ṹ����XY������X��Yԭ�����ڳɼ��ĵ�����Ŀ�ֱ���____�����ݵ������ص���ʽ�IJ�ͬ�������ﹲ�ۼ�����Ҫ������____��
(3)XY2��ZYW��Ӧʱ��ͨ�����Ʒ�Ӧ������ʵ���֮�ȣ����Եõ���ͬ�IJ����ͬ�����£���ˮ���ܽ�Ƚ�С�IJ�����________(д��ѧʽ)��
(4)д��Z2Y2�ĵ���ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��36.5 g HCl�ܽ���1 Lˮ��(ˮ���ܶȽ���Ϊ1 g��mL��1)��������Һ���ܶ�Ϊ�� g��mL��1����������Ϊw�����ʵ���Ũ��Ϊc mol��L��1��NA��ʾ�����ӵ���������������������ȷ����(����)
A. ������Һ�����ʵ���Ũ��Ϊ1 mol��L��1
B. ������Һ�к���NA��HCl����
C. 36.5 g HCl����ռ�е����Ϊ22.4 L
D. ������Һ������������w��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ա�Ϊԭ�Ϻϳ�һ������Ϳ�Ϲ̻���F��·�����£�
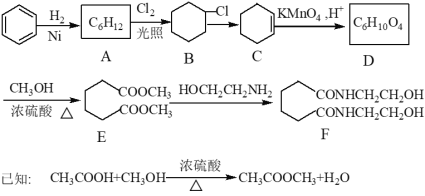
��1��A�Ľṹ��ʽΪ_____________________________��
��2��D�Ĺ���������Ϊ__________________����D��ͬ���칹���У���D������ͬ�������Ŀ�Ĺ����ţ��Һ˴Ź������ķ����֮��Ϊ3:1:1 ���л���Ľṹ��ʽΪ_________��
��3����ӦB��C�Ļ�ѧ����ʽΪ(ע����Ӧ����)_____________��
��4��д����Ӧ����: �� B��C: _____________; �� C��D:________; �� E��F:____________
��5�������ϳ�·����Ҫȱ���Dz���A��B�ķ�Ӧ, �ò������ȱ�ݵ�ԭ����_____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�һ�����ܱ������У�����һ������NO(g)������C(s)��������ӦC(s)��2NO(g) ![]() CO2(g)��N2(g)��ƽ��״̬ʱNO(g)�����ʵ���Ũ��[NO]���¶�T�Ĺ�ϵ��ͼ��ʾ��������˵������ȷ����(����)
CO2(g)��N2(g)��ƽ��״̬ʱNO(g)�����ʵ���Ũ��[NO]���¶�T�Ĺ�ϵ��ͼ��ʾ��������˵������ȷ����(����)

A. �÷�Ӧ����H>0
B. ���÷�Ӧ��T1��T2ʱ��ƽ�ⳣ���ֱ�ΪK1��K2����K1<K2
C. ��T2ʱ������Ӧ��ϵ����״̬D�����ʱһ����v��<v��
D. ��T3ʱ�������������ܶȲ��ٱ仯��������жϷ�Ӧ�ﵽƽ��״̬C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ����ѡ���װ�û�����(�г�װ������ȥ)��ȷ����
ѡ�� | A | B | C | D |
ʵ�� | ��CCl4��ȡ��ˮ�е�Br2 | ��ʳ��ˮ����ȡNaCl���� | ��KI��I2�Ĺ��������л���I2 | ����100 mL 0.100 0 mol��L-1 K2Cr2O7��Һ |
װ�û����� |
|
|
|
|
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ڶ��������·���ˮ�ⷴӦ��CH3COOC2H5+H2OCH3COOH+C2H5OH����֪�÷�Ӧ��������c(H+)��������ӿ졣��ͼΪCH3COOC2H5��ˮ��������ʱ��ı仯ͼ������˵����ȷ����(����)
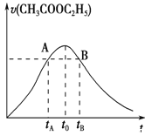
A. ��Ӧ����ˮ�����������������Һ��c(H+)����������
B. A��B�����ʾ��c(CH3COOC2H5)���
C. ͼ��t0ʱ��Ӧ�ﵽƽ��״̬
D. tBʱCH3COOC2H5��ת���ʵ���tAʱCH3COOC2H5��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ��ҵ�Ͽ�����CO��CO2������ȼ�ϼ״���ij�о�С��������йؼ״���ȡ��������ѧ��Ӧԭ������̽������֪�ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ��(K1��K2��K3)���±���ʾ��
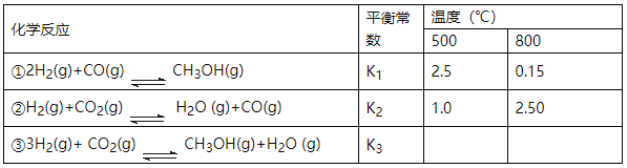
��ش��������⣺
(1)��Ӧ����__________(��������������������)��Ӧ��
(2)���ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3=___________(��K1��K2��ʾ)�����ݷ�Ӧ���жϡ�S__________0(������������=����������)����____________(�����ϸ��������ϵ���)�¶��������ڸ÷�Ӧ�Է����С�
(3)Ҫʹ��Ӧ����һ�������½�����ƽ�������ƶ����ɲ�ȡ�Ĵ�ʩ��______________(��д��ĸ���)��
a����С��Ӧ�������ݻ�
b������Ӧ�������ݻ�
c�������¶�
d��ʹ�ú��ʵĴ���
e����ƽ����ϵ�м�ʱ�����CH3OH
(4)500��ʱ����÷�Ӧ����ijʱ�̣�CO2(g)��H2(g)��CH3OH(g)��H2O(g)��Ũ�ȷֱ�Ϊ0.1mol��L-1��0.8mol��L-1��0.3mol��L-1��0.15mol��L-1�����ʱv��__________v��(������������=����������)��
(5)ij��ȤС���о���Ӧ�ڵ��淴Ӧ���������в�ͬ������ʱ��ı仯���ߣ���ʼʱ���£�t1ʱƽ�⣬t2ʱ��ѹ��t3ʱ����COŨ�ȣ�t4ʱ�ִﵽƽ�⣮�뻭��t2��t4������______��
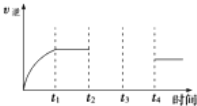
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���A��ũҩ�����е�һ���м��壬��ṹ��ʽ��ͼ��������������ȷ���ǣ� ��

A. �л���A���ڷ����廯����
B. �л���A��NaOH�Ĵ���Һ���ȿɷ�����ȥ��Ӧ
C. �л���A��Ũ�����ϼ��ȣ����Է�����ȥ��Ӧ
D. 1molA��������NaOH��Һ��Ӧ������������ 3molNaOH
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com