
【题目】如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的甲烷和Cl2,用光照射一段时间后
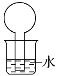
A. 只能生成CH3Cl一种有机物
B. 烧瓶内液面不可能上升
C. 烧瓶内的液体可能会分层
D. 向水中加入石蕊试液后无变化
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下:

已知:
①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中的平衡浓度与pH的关系如图所示(25℃):
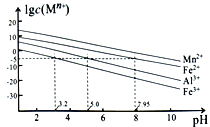
③此实验条件下Mn2+开始沉淀的pH为7.54;离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答:
(1)传统工艺处理高硫锰矿时,不经“混合焙烧”,而是直接用H2SO4浸出,其缺点为________。
(2)“氧化”时,发生反应的离子方程式为_________________________。若省略“氧化”步骤,造成的后果是_________________________。
(3)“中和除杂”时,生成沉淀的主要成分为______________________(填化学式)。
(4)“氟化除杂”时,若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于___________。(已知:Ksp(MgF2)=6.4×10-10;Ksp(CaF2)=3.6×10-12)
(5)“系列操作”指___________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种元素的原子序数依次增大。其中Y原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;X原子的L电子层中未成对电子数与Y相同,但还有空轨道;W、Z 的原子序数相差10,且Z原子的第一电离能在同周期中最低。
(1)写出下列元素的元素符号:W____,X____,Y____,Z____。
(2)XY分子中,X原子与Y原子都达到8电子稳定结构,则XY分子中X和Y原子用于成键的电子数目分别是____;根据电子云重叠方式的不同,分子里共价键的主要类型有____。
(3)XY2与ZYW反应时,通过控制反应物的物质的量之比,可以得到不同的产物,相同条件下,在水中溶解度较小的产物是________(写化学式)。
(4)写出Z2Y2的电子式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。回答下列问题:
(1)Ag与Cu在同一族,则Ag在周期表中_____(填“s”、“p”、“d”或“ds”)区。[Ag(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是_____。
(2)表中是Fe和Cu的部分电离能数据:请解释I2(Cu)大于I2(Fe)的主要原因:______。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第二电离能I2/kJ·mol-1 | 1561 | 1958 |
(3)亚铁氰化钾是食盐中常用的抗结剂,其化学式为K4[Fe(CN)6]。
①CN-的电子式是______;1mol该配离子中含σ键数目为______。
②该配合物中存在的作用力类型有______(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(4)MnO的熔点(1660℃)比MnS的熔点(1610℃)高,其主要原因是________。
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3)半导体作为吸光材料,CH3NH3PbI3具有钙钛矿(AMX3)的立方结构,其晶胞如图所示。

①AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M处于_______位置,X处于______位置(限选“体心”、“顶点”、“面心”或“棱心”进行填空)。
③CH3NH3PbI3晶体的晶胞参数为a nm,其晶体密度为dg·cm-3,则阿伏加德罗常数的值NA的计算表达式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 把100 mL 3 mol·L-1的H2SO4跟100 mL H2O混合,硫酸的物质的量浓度改变为1.5 mol·L-1
B. 把200 mL 3 mol·L-1的BaCl2溶液跟100 mL 3 mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol·L-1
C. 把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10%
D. 把100 mL 20%的NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数是10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中存在平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的说法正确的是
Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的说法正确的是
①升高温度,平衡逆向移动
②向溶液中加入少量碳酸钠粉末能增大钙离子的浓度
③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液
④恒温下,向溶液中加入CaO,溶液的pH升高
⑤给溶液加热,溶液的pH升高
⑥向溶液中加入Na2CO3溶液,其中固体质量增加
⑦向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
A. ①⑥B. ①⑥⑦C. ②③④⑥D. ①②⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5 g HCl溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
A. 所得溶液的物质的量浓度为1 mol·L-1
B. 所得溶液中含有NA个HCl分子
C. 36.5 g HCl气体占有的体积为22.4 L
D. 所得溶液的质量分数:w=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设计以苯为原料合成一种新型涂料固化剂F的路线如下:
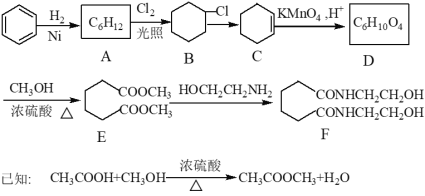
(1)A的结构简式为_____________________________。
(2)D的官能团名称为__________________。在D的同分异构体中,与D含有相同种类和数目的官能团,且核磁共振氢谱的峰面积之比为3:1:1 的有机物的结构简式为_________。
(3)反应B→C的化学方程式为(注明反应条件)_____________。
(4)写出反应类型: ① B→C: _____________; ② C→D:________; ③ E→F:____________
(5)上述合成路线主要缺陷是步骤A→B的反应, 该步骤存在缺陷的原因是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如下表所示:
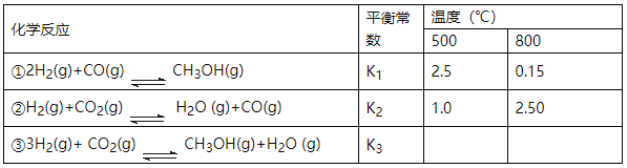
请回答下列问题:
(1)反应②是__________(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=___________(用K1、K2表示);根据反应③判断△S__________0(填“>”、“=”或“<”),在____________(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有______________(填写字母序号)。
a.缩小反应容器的容积
b.扩大反应容器的容积
c.升高温度
d.使用合适的催化剂
e.从平衡体系中及时分离出CH3OH
(4)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol·L-1、0.8mol·L-1、0.3mol·L-1、0.15mol·L-1,则此时v正__________v逆(填“>”、“=”或“<”)。
(5)某兴趣小组研究反应②的逆反应速率在下列不同条件随时间的变化曲线,开始时升温,t1时平衡,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com