
【题目】为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。回答下列问题:
(1)Ag与Cu在同一族,则Ag在周期表中_____(填“s”、“p”、“d”或“ds”)区。[Ag(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是_____。
(2)表中是Fe和Cu的部分电离能数据:请解释I2(Cu)大于I2(Fe)的主要原因:______。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第二电离能I2/kJ·mol-1 | 1561 | 1958 |
(3)亚铁氰化钾是食盐中常用的抗结剂,其化学式为K4[Fe(CN)6]。
①CN-的电子式是______;1mol该配离子中含σ键数目为______。
②该配合物中存在的作用力类型有______(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(4)MnO的熔点(1660℃)比MnS的熔点(1610℃)高,其主要原因是________。
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3)半导体作为吸光材料,CH3NH3PbI3具有钙钛矿(AMX3)的立方结构,其晶胞如图所示。

①AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M处于_______位置,X处于______位置(限选“体心”、“顶点”、“面心”或“棱心”进行填空)。
③CH3NH3PbI3晶体的晶胞参数为a nm,其晶体密度为dg·cm-3,则阿伏加德罗常数的值NA的计算表达式为_________。
【答案】ds 直线形 失去第二个电子时,Cu失去的是全充满3d10 电子,Fe 失去的是4s1电子 ![]() 12NA BCD 二者均为离子晶体,O2-半径小于S2-半径,MnO的晶格能大于MnS 体心 面心
12NA BCD 二者均为离子晶体,O2-半径小于S2-半径,MnO的晶格能大于MnS 体心 面心 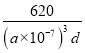
【解析】
(1)Ag在第五周期第ⅠB族,属于ds区;依题意:[Ag(NH3)2]+中Ag+以sp杂化成键,应该是直线形;
(2)Cu+的价电子排布式为3d10,Fe+的价电子排布式为3d64s1,Cu+再失去的是3d10上的电子,而Fe+失去的是4s1的电子,由于原子核外电子处于全充满、半充满或全空时是稳定的状态,显然3d10处于全充满,更稳定。所以失去第二个电子时,Cu 失去的是全充满 3d10 电子,需要的能量高,而Fe 失去的是 4s1 电子,所需能量低;故I2(Cu)大于I2(Fe)。
(3)①CN-与N2是等电子体,结构相似,根据氮气电子式书写氢氰根离子电子式为![]() ;CN-与Fe2+以配位键结合,这6个配位键都属于σ键,还有6个CN-中各有一个σ键,1个配离子中含有的σ键共有12个,则1mol该配离子中含有 12 NA个σ键;
;CN-与Fe2+以配位键结合,这6个配位键都属于σ键,还有6个CN-中各有一个σ键,1个配离子中含有的σ键共有12个,则1mol该配离子中含有 12 NA个σ键;
②K4 [Fe(CN)6]是离子化合物,含有离子键,阳离子K+与配离子之间以离子键结合,Fe2+与CN-以配位键结合,CN-中的两种原子以极性共价键结合, 故选BCD;
(4)MnO和MnS的阳离子相同,阴离子所带电荷也相同,但是O2-的半径比S2-小,离子键作用力强,所以MnO中的晶格能比MnS中的大,物质的熔点也比MnS的高;
(5)①依题意可知:卤素阴离子位于立方体的6个面的面心,正好构成正八面体,M位于八面体的体心,也是立方体的体心;
②晶体体积=晶体体积=a3×10-21cm3,晶体密度ρ=![]() ,则NA =
,则NA = ![]() 。1mol晶胞含1molCH3NH3PbI3,据d=
。1mol晶胞含1molCH3NH3PbI3,据d=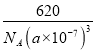 ,所以NA=
,所以NA=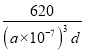 。
。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是
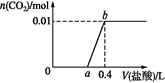
A. 在0~a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:![]()
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2O黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。种制取Cl2O 的装置如图所示。

已知:C12O的熔点为-116℃,沸点为3.8℃,Cl2 的沸点为-34.6℃;HgO+2Cl2=HgCl2 +Cl2O
下列说法不正确的是
A. 装置②、③中盛装的试剂依次是饱和食盐水和浓硫酸
B. 通入干燥空气的目的是将生成的Cl2O稀释减少爆炸危险
C. 从装置⑤中逸出气体的主要成分是Cl2O
D. 装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
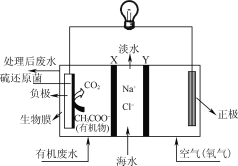
A. 该装置可以在高温下工作
B. X、Y依次为阳离子、阴离子选择性交换膜
C. 负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D. 该装置工作时,电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七叶树内酯的结构如下图,若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
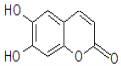
A. 2molBr2、2molNaOHB. 2molBr2、3molNaOH
C. 3molBr2、4molNaOHD. 4molBr2、4molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是一种新型香料的主要成分之一,其结构中含有三个六元环。G的合成路线如图(部分产物和部分反应条件略去):
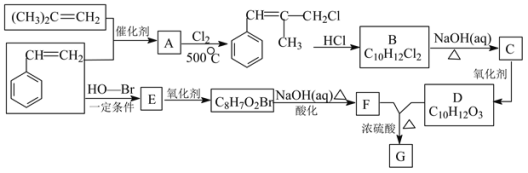
已知:①RCH=CH2+CH2=CHR’![]() CH2=CH2+RCH=CHR’
CH2=CH2+RCH=CHR’
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子;
③D和F是同系物。
请回答下列问题:
(1)(CH3)2C=CH2的系统命名法名称为____,该分子中最多有__个原子在同一平面内。
(2)A→B反应过程中涉及的反应类型依次为___、___。
(3)D分子中含有的含氧官能团名称是___,G的结构简式为___。
(4)生成E的化学方程式为____。
(5)同时满足下列条件:①与FeCl3溶液发生显色反应;②苯环上有两个取代基、含C=O的F的同分异构体有多种,其中核磁共振氢谱为4组峰、能水解的物质的结构简式为___。
(6)模仿由苯乙烯合成F的方法,写出由丙烯制取α-羟基丙酸(![]() )的合成路线:_____。
)的合成路线:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的甲烷和Cl2,用光照射一段时间后
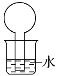
A. 只能生成CH3Cl一种有机物
B. 烧瓶内液面不可能上升
C. 烧瓶内的液体可能会分层
D. 向水中加入石蕊试液后无变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合溶液中,各离子浓度的大小顺序正确的是
A. 10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:c(Cl)>c(![]() )>c(OH)>c(H+)
)>c(OH)>c(H+)
B. 10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(Cl)>c(OH)>c(H+)
C. 10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(CH3COO)>c(OH)>c(H+)
D. 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl)>c(Na+)>c(OH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100 mL 0.3 mol·L-1 Na2SO4溶液和50 mL 0.2 mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为( )
A. 0.20 mol·L-1B. 0.25 mol·L-1
C. 0.40 mol·L-1D. 0.50 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com