
【题目】已知溶液中存在平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的说法正确的是
Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的说法正确的是
①升高温度,平衡逆向移动
②向溶液中加入少量碳酸钠粉末能增大钙离子的浓度
③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液
④恒温下,向溶液中加入CaO,溶液的pH升高
⑤给溶液加热,溶液的pH升高
⑥向溶液中加入Na2CO3溶液,其中固体质量增加
⑦向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
A. ①⑥B. ①⑥⑦C. ②③④⑥D. ①②⑥⑦
【答案】A
【解析】
①升高温度,平衡向吸热即逆反应向移动;
②向溶液中加入少量碳酸钠粉末,反应产生碳酸钙沉淀;
③除去氯化钠溶液中混有的少量Ca2+,根据平衡移动原理分析;
④恒温下,向饱和溶液中加入CaO,发生CaO+H2O=Ca(OH)2,仍然为氢氧化钙饱和溶液;
⑤Ca(OH)2的溶解度随温度的升高而降低;
⑥向溶液中加入Na2CO3 溶液,氢氧化钙转化成碳酸钙沉淀,固体质量增加;
⑦向溶液中加入少量NaOH固体,OH-浓度增大,平衡向逆方向移动。
①Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) ΔH<0,该反应为放热反应,升高温度平衡向吸热的逆反应向移动,①正确;
Ca2+(aq)+2OH-(aq) ΔH<0,该反应为放热反应,升高温度平衡向吸热的逆反应向移动,①正确;
②向溶液中加入少量碳酸钠粉末,CO32-与Ca2+结合生成CaCO3沉淀,导致溶液中c(Ca2+)减小,②错误;
③若要除去氯化钠溶液中混有的少量Ca2+,加入适量的NaOH溶液,形成氢氧化钙,并不能除去钙离子,反而会引入氢氧化钙杂质,③错误;
④恒温下,向饱和溶液中加入CaO,发生CaO+H2O=Ca(OH)2,仍为该温度下的饱和溶液,Ca(OH)2的浓度不变,溶液的pH不变,④错误;
⑤由于Ca(OH)2的溶解度随温度的升高而降低,所以给溶液加热,Ca(OH)2的溶解度降低,氢氧根离子的浓度减小,则溶液pH减小,⑤错误;
⑥向溶液中加入Na2CO3 溶液,发生反应Ca2++CO32-=CaCO3↓,导致固体质量增加,⑥正确;
⑦向溶液中加入少量NaOH固体,NaOH溶解电离产生OH-,使溶液中OH-浓度增大,根据平衡移动原理,增大OH-的浓度,Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq)的平衡向逆方向移动,最终达到平衡时,Ca(OH)2固体的质量会增多,⑦错误;
Ca2+(aq)+2OH-(aq)的平衡向逆方向移动,最终达到平衡时,Ca(OH)2固体的质量会增多,⑦错误;
则合理说法是①⑥,故正确选项是A。


科目:高中化学 来源: 题型:
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )

A. 原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B. 反应最后形成的溶液中的溶质含AlCl3
C. 原溶液中Al3+与NH的物质的量之比为1∶3
D. 原溶液中含有的阴离子是Cl-、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
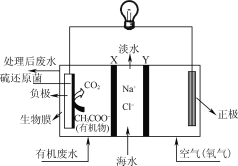
A. 该装置可以在高温下工作
B. X、Y依次为阳离子、阴离子选择性交换膜
C. 负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D. 该装置工作时,电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是一种新型香料的主要成分之一,其结构中含有三个六元环。G的合成路线如图(部分产物和部分反应条件略去):
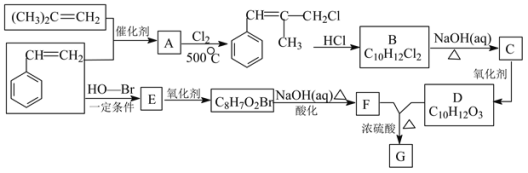
已知:①RCH=CH2+CH2=CHR’![]() CH2=CH2+RCH=CHR’
CH2=CH2+RCH=CHR’
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子;
③D和F是同系物。
请回答下列问题:
(1)(CH3)2C=CH2的系统命名法名称为____,该分子中最多有__个原子在同一平面内。
(2)A→B反应过程中涉及的反应类型依次为___、___。
(3)D分子中含有的含氧官能团名称是___,G的结构简式为___。
(4)生成E的化学方程式为____。
(5)同时满足下列条件:①与FeCl3溶液发生显色反应;②苯环上有两个取代基、含C=O的F的同分异构体有多种,其中核磁共振氢谱为4组峰、能水解的物质的结构简式为___。
(6)模仿由苯乙烯合成F的方法,写出由丙烯制取α-羟基丙酸(![]() )的合成路线:_____。
)的合成路线:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的甲烷和Cl2,用光照射一段时间后
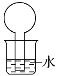
A. 只能生成CH3Cl一种有机物
B. 烧瓶内液面不可能上升
C. 烧瓶内的液体可能会分层
D. 向水中加入石蕊试液后无变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式____________________。
(2)下列三种情况下,离子方程式与(1)相同的是_____(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度![]() 表示)可近似地用图中的_____曲线表示(填序号)。
表示)可近似地用图中的_____曲线表示(填序号)。
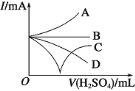
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示,向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将_____(选填“上浮”、“不动”、“下降”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合溶液中,各离子浓度的大小顺序正确的是
A. 10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:c(Cl)>c(![]() )>c(OH)>c(H+)
)>c(OH)>c(H+)
B. 10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(Cl)>c(OH)>c(H+)
C. 10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(CH3COO)>c(OH)>c(H+)
D. 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl)>c(Na+)>c(OH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量的混合气体发生反应:xA(g)+yB(g)![]() zC(g)平衡时测得C的浓度为1 mol·L-1,保持温度不变,将容器的容积扩大到原来的2倍,再达到平衡时,测得C的浓度为0.6 mol·L-1,下列有关判断正确的是( )
zC(g)平衡时测得C的浓度为1 mol·L-1,保持温度不变,将容器的容积扩大到原来的2倍,再达到平衡时,测得C的浓度为0.6 mol·L-1,下列有关判断正确的是( )
A. x+y>zB. 平衡向逆反应方向移动
C. B的转化率降低D. A的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
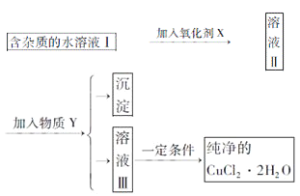
【题目】已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性,将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH的数据如下表所示。现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:
氢氧化物 | 开始沉淀pH | 完全沉淀pH |
Fe(OH)2 | 6.5 | 9.7 |
Fe(OH)3 | 1.5 | 3.7 |
Cu(OH)2 | 4.2 | 6.7 |
请回答下列问题:
(1)本实验最适合的氧化剂X是__________。(选填下面的序号)
A K2Cr2O7 B NaClO C H2O2 D KMnO4
(2)物质Y是________。
(3)本实验用加碱沉淀的目的是否能达到?________________。原因是________________。
(4)除去Fe3+的化学方程式为____________________,_________________________________。
(5)加氧化剂的目的为________________________。
(6)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________________。应如何操作________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com