
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)+Q1 K1 (Ⅰ)
2NO(g)+Cl2(g)2ClNO(g)+Q2 K2 (Ⅱ)
(1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____(用含K1、K2的代数式表示).
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡.测得在10min内v(ClNO)=7.5×10﹣3molL﹣1min﹣1,则平衡后n(Cl2)=_____mol,NO的转化率а1=____.其它条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率а2____а1(填“>”“<”或“=”),平衡常数K2____(填“增大”“减小”或“不变”).若要使K2减小,可采用的措施是____.
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH→NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1molL﹣1的CH3COONa溶液,则两溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为____.(已知HNO2的电离常数Ka=7.1×10﹣4molL﹣1,CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1,可使溶液A和溶液B的pH相等的方法是____.
a 向溶液A中加适量水 b 向溶液A中加适量NaOH
c 向溶液B中加适量水 d 溶液B中加适量NaOH.
【答案】![]() 0.025 75% > 不变 升高温度 c(NO3﹣)>c(NO2﹣)>c(CH3COO﹣) bc
0.025 75% > 不变 升高温度 c(NO3﹣)>c(NO2﹣)>c(CH3COO﹣) bc
【解析】
(1)结合已知反应化学方程式判断与4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的关系,结合平衡常数表达式计算得到平衡常数关系;
(2)依据平衡三段式列式计算,依据反应速率概念计算V=![]() 、转化率概念的计算,转化率=
、转化率概念的计算,转化率=![]() ×100%,反应(Ⅱ)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强比恒容容器大,平衡正向进行,平衡时NO的转化率α2增大;平衡常数随温度变化,不随浓度、压强变化,若要使K2减小,平衡逆向进行,反应是放热反应,依据平衡移动原理应升高温度,平衡逆向进行,平衡常数随温度变化;
×100%,反应(Ⅱ)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强比恒容容器大,平衡正向进行,平衡时NO的转化率α2增大;平衡常数随温度变化,不随浓度、压强变化,若要使K2减小,平衡逆向进行,反应是放热反应,依据平衡移动原理应升高温度,平衡逆向进行,平衡常数随温度变化;
(3)0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,反应为2NO2+2NaOH═NaNO3+NaNO2+H2O,得到溶液中NaNO3物质的量浓度为0.1mol/L,NaNO2物质的量为0.1mol/L,溶液B为0.1molL-1的CH3COONa溶液,已知HNO2的电离常数Ka=7.1×10-4molL-1,CH3COOH的电离常数Ka=1.7×10-5molL-1,说明CH3COOH酸性小于HNO2的酸性,对应阴离子水解程度大.
(1) 2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)+Q1 K1 (Ⅰ)
2NO(g)+Cl2(g)2ClNO(g)+Q2 K2 (Ⅱ)
由I×2II得到4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g),则K=![]() ,
,
故答案为:![]() ;
;
(2)在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应(Ⅱ)达到平衡,测得10min内v(ClNO)=7.5×103 molL﹣1min﹣1,物质的量为7.5×103 molL﹣1min﹣1×10min×2L=0.15mol,
2NO(g)+Cl2(g)2ClNO(g),
起始量(mol)0.2 0.1 0
变化量(mol)0.15 0.0750.15
平衡量(mol)0.05 0.0250.15
则平衡后n(Cl2)=0.025mol,
NO的转化率α1=0.15mol÷0.2mol×100%=75%;
其他条件保持不变,反应(Ⅱ)在恒压条件下进行,随反应进行,气体体积减小,为保持恒压所以容器体积减小,压强比恒容容器大,平衡正向进行,平衡时NO的转化率α2增大;平衡常数随温度变化,不随浓度、压强变化,若要使K2减小,平衡逆向进行,反应是放热反应,依据平衡移动原理应升高温度,平衡逆向进行;
故答案为:0.025;75%;>;不变;升高温度;
(3) 0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,反应为2NO2+2NaOH═NaNO3+NaNO2+H2O,得到溶液中NaNO3物质的量浓度为0.1mol/L,NaNO2物质的量为0.1mol/L,溶液B为0.1molL-1的CH3COONa溶液,已知HNO2的电离常数Ka=7.1×10-4molL
使溶液A和溶液B的pH值相等的方法,依据溶液组成和性质分析,溶液A中NaNO3物质的量浓度为0.1mol/L,NaNO2物质的量为0.1mol/L,溶液B为0.1molL1的CH3COONa溶液,溶液B碱性大于A溶液;
a、上述分析可知,溶液B碱性大于A溶液,向溶液A中加适量水,稀释溶液,碱性减小,不能调节溶液PH相同,故a不符合;
b、向溶液A中加适量NaOH,增大碱性,可以调节溶液pH相同,故b符合;
c、向溶液B中加适量水,稀释溶液碱性减弱,可以调节溶液pH,故c符合;
d、溶液B碱性大于A溶液,向溶液B中加适量NaOH,溶液PH更大,不能调节溶液PH相同,故d不符合;
故答案为:c(NO3﹣)>c(NO2﹣)>c(CH3COO﹣);bc。


科目:高中化学 来源: 题型:
【题目】请回答以下问题
(1)某温度时,测得pH=11的Ba(OH)2溶液浓度是0.005mol·L-1。
①该温度下水的离子积常数Kw=________。
②在此温度下,将pH=12的Ba(OH)2溶液Va L与pH=2的硫酸Vb L混合。若所得混合液为中性,则Va∶Vb=________。
(2)25 ℃时,部分物质的电离平衡常数如下表所示。请回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10—5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①下列说法正确的是__________
A.25 ℃时,向CH3COOH溶液中加入适量的NaOH溶液,CH3COOH的电离程度增大,电离平衡常数不变
B.0.1molL-1 CH3COOH溶液加水稀释,稀释后的溶液中水的电离程度减小
C.0.1molL-1 HClO溶液和0.1molL-1 NaClO溶液等体积混合呈溶液碱性
D.碳酸氢钠溶液中阴阳离子数目相等
② 同浓度的CH3COO-、HCO、CO32-、ClO-结合H+的能力由强到弱的顺序为___
③ 25 ℃时,某CH3COOH和CH3COOK混合溶液呈中性,则该混合溶液中:![]() =________
=________
(3)煤燃烧排放的烟气含有SO2和NO,采用碱性的NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应10min后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式______。
②如果采用Ca(ClO)2替代NaClO2,其脱硫效果会更好。试从化学平衡原理分析,Ca(ClO)2相比NaClO2具有的优点是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 苯酚钠溶液中通入少量的二氧化碳,产物是苯酚和碳酸钠
B. 苯的同系物中,苯环和侧链相互影响,使得二者均易被氧化
C. ![]() 在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2
在核磁共振氢谱中出现两组峰,其氢原子数之比为3:2
D. 苯甲醛、苯乙烯分子中的所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:

①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体,硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:_________;
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是_________;
(3)检验淀粉是否水解完全所用的试剂为_________;
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________;
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020molL﹣1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为_________,滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由物质a为原料,制备物质d(金刚烷)的合成路线如下图所示:
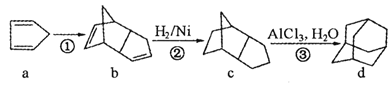
关于以上有机物的说法中,不正确的是
A. a分子中所有原子均在同一平面内 B. a和Br2按1:1加成的产物有两种
C. d的一氯代物有两种 D. c与d的分子式相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物C的分子式为C9H9OCl。C分子中有一个甲基且苯环上只有一条侧链;一定条件下C能发生银镜反应;
C与其他物质之间的转化如下图所示:
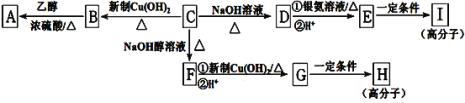
(1)C的结构简式是__________________。
(2)E中含氧官能团的名称是___________; C→F的反应类型是___________。
(3)写出下列化学方程式:G在一定条件下合成H的反应________________________。
(4)D的一种同系物W(分子式为C8H8O2)有多种同分异构体,则符合以下条件W的同分异构体有________种,写出其中核磁共振氢谱有4个峰的结构简式____________。
①属于芳香族化合物 ②遇FeCl3溶液不变紫色 ③能与NaOH溶液发生反应但不属于水解反应
(5)请设计合理方案由![]() 合成
合成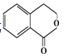 __________(无机试剂任选,用反应流程图表示,并注明反应条件)。
__________(无机试剂任选,用反应流程图表示,并注明反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知相同温度下CH3COOH和NH3H2O的电离常数相等,现向10mL浓度为0.1molL﹣1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.c(NH4+):c(NH3H2O)始终减小
C.c(CH3COOH)与c(CH3COO)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的实验装置制备少量乙酸乙酯。请回答问题,将所选方法的数字代号填在括号中:
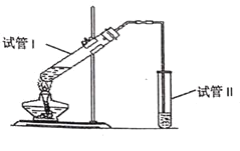
(1)试管Ⅰ中盛有由2mL浓硫酸、3mL乙醇、2mL冰醋酸组成的反应混合液,其中浓硫酸的作用是________。
①催化剂和吸水剂,②脱水剂
(2)试管Ⅱ中的导管口为什么要在液面之上?________。
①防止倒吸,②有利于气体导出
(3)试管Ⅱ中的Na2CO3溶液的主要作用是(不定项)________。
①降低乙酸乙酯在溶液中的溶解度;
②除去挥发出的乙酸;
③溶解挥发出的乙醇。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com