
【题目】用如图所示的实验装置制备少量乙酸乙酯。请回答问题,将所选方法的数字代号填在括号中:
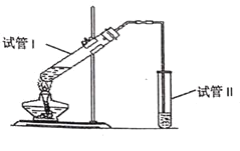
(1)试管Ⅰ中盛有由2mL浓硫酸、3mL乙醇、2mL冰醋酸组成的反应混合液,其中浓硫酸的作用是________。
①催化剂和吸水剂,②脱水剂
(2)试管Ⅱ中的导管口为什么要在液面之上?________。
①防止倒吸,②有利于气体导出
(3)试管Ⅱ中的Na2CO3溶液的主要作用是(不定项)________。
①降低乙酸乙酯在溶液中的溶解度;
②除去挥发出的乙酸;
③溶解挥发出的乙醇。
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g)+Q1 K1 (Ⅰ)
2NO(g)+Cl2(g)2ClNO(g)+Q2 K2 (Ⅱ)
(1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____(用含K1、K2的代数式表示).
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡.测得在10min内v(ClNO)=7.5×10﹣3molL﹣1min﹣1,则平衡后n(Cl2)=_____mol,NO的转化率а1=____.其它条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率а2____а1(填“>”“<”或“=”),平衡常数K2____(填“增大”“减小”或“不变”).若要使K2减小,可采用的措施是____.
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH→NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1molL﹣1的CH3COONa溶液,则两溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为____.(已知HNO2的电离常数Ka=7.1×10﹣4molL﹣1,CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1,可使溶液A和溶液B的pH相等的方法是____.
a 向溶液A中加适量水 b 向溶液A中加适量NaOH
c 向溶液B中加适量水 d 溶液B中加适量NaOH.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扁桃酸衍生物是重要的医药中间体。以A和B为原料合成扁桃酸衍生物F的路线如下:
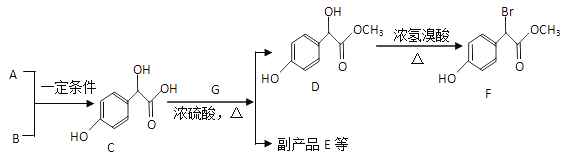
(1) A的分子式为C2H2O3,可发生银镜反应,且具有酸性,写出A+B→C的化学反应方程式:________
(2)C( )中①、②、③3个—OH的酸性由强到弱的顺序是______
)中①、②、③3个—OH的酸性由强到弱的顺序是______
(3)E是由2分子C生成的含有3个六元环的化合物,E分子中不同化学环境的氢原子有____种
(4)D→F的反应类型是________,1 mol F在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为____mol,写出符合下列条件的F的同分异构体2种(不考虑立体异构)的结构简式:_____
①属于一元酸类化合物
②苯环上只有2个取代基且处于对位,其中一个是羟基
(5)已知:
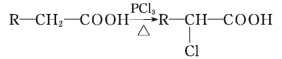
A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选) ______________(合成路线流程图示例如下:
H2C![]() CH2
CH2![]() CH3CH2OH
CH3CH2OH![]() CH3COOC2H5
CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将有机物完全燃烧,生成CO2和H2O,将12 g该有机物完全燃烧产物通过浓硫酸,浓硫酸增重14.4 g,再通过碱石灰,又增重26.4 g。则该有机物的分子式为( )
A. C4H10 B. C2H6O
C. C3H8O D. C2H4O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一名同学把4.48 L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8 mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
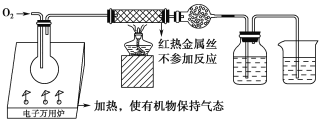
实验结束后发现无水CuSO4变蓝,干燥管和洗气瓶共增重18 g,澄清石灰水变浑浊后又恰好变澄清。请根据实验回答下列问题:
(1)O2要过量的原因是:________________。
(2)若该有机物只含C、H两种元素,且不含任何官能团,也不含脂环,则该有机物的分子式为________,它可能属于________(填序号)。
A.烷烃 B.苯的同系物 C.芳香烃 D.烃的衍生物
该物质可能的结构简式为_____________________。
(3)若该有机物分子中含有一个氧原子,则它可能是哪几类物质?请各举一例,填写在下表中:
物质种类 | 实例(写结构简式) |
_________ | _________ |
_________ | _________ |
_________ | _________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结晶玫瑰广泛用于香料中,它的两条合成路线如下图所示:
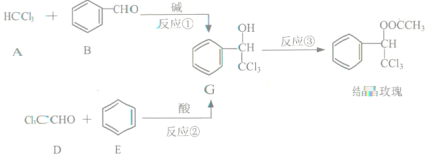
已知:两个羟基同时连在同一碳原子上的结构不稳定,会发生脱水反应:
![]() +H2O
+H2O
完成下列填空:
(1)A的俗称是_________;D中官能团的名称是_______;反应②的反应类型是_______。
(2)写出G与氢氧化钠溶液反应的化学方程式__________。
(3)已知: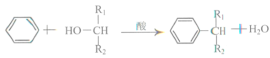 ,则可推知反应②发生时,会得到一种副产物,写出该副产物的结构简式_____。
,则可推知反应②发生时,会得到一种副产物,写出该副产物的结构简式_____。
(4)G的同分异构体L遇FeCl3溶液显色,与足量浓溴水反应未见白色沉淀产生,若L与NaOH的乙醇溶液共热能反应,则共热生成的有机物的结构简式为________________(任写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为:
![]() 。下列说法正确的是
。下列说法正确的是
A.放电时正极反应为:![]()
B.充电时阴极反应为:![]()
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.充电过程中,H+由阴极区向阳极区迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4和N2一定条件下能直接生成氨:3CH4(g)+2N2(g)![]() 3C(s)+4NH3(g)-Q,700℃时,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如所示。正确的是
3C(s)+4NH3(g)-Q,700℃时,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如所示。正确的是
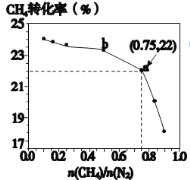
A.n(CH4)/n(N2)越大,CH4的转化率越高
B.n(CH4)/n(N2)不变时,升温,NH3的体积分数会增大
C.b点对应的平衡常数比a点的大
D.a点对应的NH3的体积分数约为13%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请阅读下列材料,完成下面小题。
随着社会经济的发展,汽车已进入千家万户,它给人们出行带来方便的同时汽车尾气污染问题也日益突显,汽车尾气中含NO、NO2、CO2、SO2和固体悬浮颗粒等。用活性炭还原处理氮氧化物是一种实用的氮氧化物转化方法:C(s)+2NO(g) ![]() N2(g)+CO2(g),可实现氮氧化物无害转化。
N2(g)+CO2(g),可实现氮氧化物无害转化。
【1】下列环境问题与汽车尾气的大量排放无关的是
A.酸雨B.温室效应C.PM2.5超标D.白色污染
【2】该反应属于化学基本反应类型中的
A.化合反应B.分解反应C.置换反应D.复分解反应
【3】该反应属于氧化还原反应,下列说法正确是
A.C元素被还原B.NO得到电子C.NO发生氧化反应D.CO2是氧化剂
【4】关于该反应下列说法不正确的是
A.升高温度能够加快反应速率
B.降低NO浓度能够减慢反应速率
C.使用合适的催化剂可以加快反应速率
D.加入足量的炭粉可以使NO 100%转化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com