
����Ŀ��CH4��N2һ����������ֱ�����ɰ���3CH4��g��+2N2��g��![]() 3C��s��+4NH3��g����Q��700��ʱ��CH4��N2�ڲ�ͬ���ʵ���֮��[n��CH4��/n��N2��]ʱCH4��ƽ��ת��������ʾ����ȷ����
3C��s��+4NH3��g����Q��700��ʱ��CH4��N2�ڲ�ͬ���ʵ���֮��[n��CH4��/n��N2��]ʱCH4��ƽ��ת��������ʾ����ȷ����
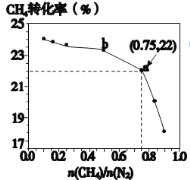
A.n��CH4��/n��N2��Խ��CH4��ת����Խ��
B.n��CH4��/n��N2������ʱ�����£�NH3���������������
C.b���Ӧ��ƽ�ⳣ����a��Ĵ�
D.a���Ӧ��NH3���������ԼΪ13%
���𰸡�BD
��������
��ͼ��֪��������Ϊ�����ת���ʣ�������Ϊ![]() ��
��![]() Խ�����ת����ԽС��ƽ�������ƶ�ʱ�������������������ƽ�ⳣ��ֻ���¶��йأ�������a�����ת����Ϊ
Խ�����ת����ԽС��ƽ�������ƶ�ʱ�������������������ƽ�ⳣ��ֻ���¶��йأ�������a�����ת����Ϊ![]() ���㰱��������������Դ������
���㰱��������������Դ������
A����ͼ����![]() ��ת������
��ת������![]() ����������ͣ�A����
����������ͣ�A����
B��![]() ���÷�Ӧ�����ȷ�Ӧ�������¶�ƽ�������ƶ���
���÷�Ӧ�����ȷ�Ӧ�������¶�ƽ�������ƶ���![]() ���������������B��ȷ��
���������������B��ȷ��
C��ab������¶���ͬ��ƽ�ⳣ��ֻ���¶��йأ���ƽ�ⳣ�����䣬C����
D��a�����ת����Ϊ![]() ��
��![]() ���������Ϊ3mol������Ϊ4mol��
���������Ϊ3mol������Ϊ4mol�� ![]()
![]()
![]()
��ʼ 3 4 0
ת��![]()
![]()
![]()
ƽ�� ![]()
![]()
![]()
��![]() ���������ԼΪ
���������ԼΪ![]() ��D��ȷ��
��D��ȷ��
��ѡBD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ͬ�¶���CH3COOH��NH3H2O�ĵ��볣����ȣ�����10mLŨ��Ϊ0.1molL��1��CH3COOH��Һ�еμ���ͬŨ�ȵİ�ˮ���ڵμӹ����У�������
A.ˮ�ĵ���̶�ʼ������
B.c��NH4+����c��NH3H2O��ʼ�ռ�С
C.c��CH3COOH����c��CH3COO��֮��ʼ�ձ��ֲ���
D.�����백ˮ�����Ϊ10mLʱ��c��NH4+��=c��CH3COO����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ��ʵ��װ���Ʊ�����������������ش����⣬����ѡ���������ִ������������У�
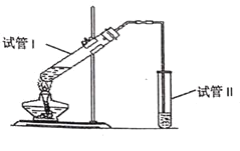
(1)�Թܢ���ʢ����2mLŨ���ᡢ3mL�Ҵ���2mL��������ɵķ�Ӧ���Һ������Ũ�����������________��
�ٴ�������ˮ��������ˮ��
(2)�Թܢ��еĵ��ܿ�ΪʲôҪ��Һ��֮��?________��
�ٷ�ֹ�����������������嵼��
(3)�Թܢ��е�Na2CO3��Һ����Ҫ������(������)________��
�ٽ���������������Һ�е��ܽ�ȣ�
�ڳ�ȥ�ӷ��������
���ܽ�ӷ������Ҵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ò���ѹǿ�������ⶨ������90%������Һ�з�����ʴ��װ�ü�������ѹǿ��ʱ��仯��ͼ��ʾ�����з����������

A.0~t1�����ܷ��������ⸯʴѹǿ����
B.0~t1�����ܷ�Ӧ�����¶�����ѹǿ����
C.t2ʱѹǿС����ʼѹǿ��һ��������������ʴ
D.�������������۷����˻�ԭ��Ӧ����Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ����ǽ�_____��ת����_____�ܵ�һ��װ�á�һ������ԭ���ԭ���Ʊ�NH3��װ����ͼ��ʾ���մ��ڸ���ʱ���Դ���H+�����豸�У��缫____(����a������b��)����������缫��ӦʽΪ��_____������·��ͨ��1.2mol�ĵ���ʱ��������NH3____mol��
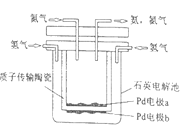
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NO��NO2�ɱ���ˮ��Һ���գ�6NO+ 4NH3��5N2+6H2O��6NO2+ 8NH3��7N2+12H2O��������NO��NO2������N2O4���������90mol��30%�İ�ˮ4.45��103g��ȫ���գ�����78mol���������պ�ˮ�ܶ�Ϊ0.980 g/cm3����
A.ԭ��������ƽ�����ΪNO1.1B.ԭ��ˮ��Ũ��ԼΪ17.3mol/L
C.���պ�ˮ��Ũ��ԼΪ2.4mol/LD.���պ�ˮ����������ԼΪ0.5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȩ������������Ҫ��һ�壬����ȩ��������������ζ�������Ǻϳ�����ȩ��һ��·�ߣ�
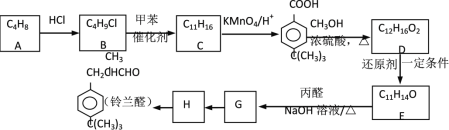
��֪���� R1�DCHO + R2�DCH2�DCHO ![]() R1�DCH=C�DCHO
R1�DCH=C�DCHO
�� R�DCl +![]()
![]()
![]() + HCl
+ HCl
���������գ�
��1���A������_____________��
��2��д���ṹ��ʽ��C_______��E_________��
��3��������M��G�ķ�����ͬ���칹�壬M��������������
���ܷ���������Ӧ�����ڱ�����1��3��5λ��������������������������C2H3��C4H9�����������M��ͬ���칹�干_______�֡�
��4��д��H��������ȩ�Ļ�ѧ����ʽ��_______��
��5��E��Gת���Ĺ����У����з���ʽΪC17H22O�ĸ�����K������K�Ľṹ��ʽ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.02mol/LMOH��Һ��ε���100mL0.01mol/LHA��Һ�У���ҺpH�����MOH��Һ������仯��ͼ��ʾ����������Һ���ʱ������仯������������ȷ���ǣ� ��
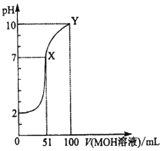
A.�¶Ȳ��䣬����MOH��Һ�Ĺ�����ˮ�ĵ���̶Ȳ���
B.X��MOH����������Һ��c(M+)��c(A��)
C.HAΪ���ᣬMOHΪǿ��
D.Y���c(MOH)��c(M+)��0.01mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
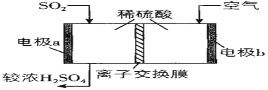
����Ŀ������������������Ⱦ����ҪϤ���о���
(1)������������ڴ����������ᡣ���Ṥҵ�У���Ϊ������ V2O5�Է�Ӧ I �Ĵ�ѭ�����̾����ˢ�������Ӧ�Σ���ͼ��ʾ��

д�� V2O5��SO3�μӷ�Ӧ��Ļ�ѧ����ʽ_____��
(2)�� 2molSO2�� 1molO2�����ܱ������У���һ�������·�����Ӧ��2SO2(g)+O2(g)2SO3(g)��ƽ��ʱ SO3���������(% )���¶Ⱥ�ѹǿ�ı仯�����ʾ��
1.0 | 2.0 | 3.0 | |
350 | 54.0 | a | b |
415 | c | 40.0 | d |
550 | e | f | 36.0 |
�����ж���ȷ����______________
A.b >e
B.415�桢2.0MPaʱO2��ת����Ϊ60%
C.��һ���¶Ⱥ�ѹǿ�£����� V2O5�������ܼӿ췴Ӧ���ʣ���� SO3 ���������
D.ƽ�ⳣ�� K(550��)>K(350��)
(3)�ϴ��� SO2��������ԭ��ط��������ᡣͼ�����ӽ���Ĥ��___________���ӽ���Ĥ(����������������)
(4)�о����ֺ���ʽ����������Һ��SO2 ��ϵķ�ʽ��2�֣���һ������Һ�е�ˮ��ϡ���������ʽ�������еĻ���Al2O3��ϣ�ͨ����ȼƲⶨ����Һ��pH�仯�������ͼ��ʾ��

�����������ͼ�仯��ԭ��____
(5)ȡ��ȷ�SO3���ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�������Ӧ��3SO3(g)(SO3)3(g) ��H<0����Ӧ��ͬʱ��ֱ�ⶨ��ϵ��SO3�İٷֺ��������������淴Ӧ�¶�(T)�仯�Ĺ�ϵͼ������ʾ��ͼ�У�������ʵ�����������________________
A.  B.
B.  C.
C.  D.
D. 
(6)�� Na2SO3 ��Һ��Ϊ����Һ���� SO2 ʱ������Ϊ NaHSO3����֪���������������ƽ�ⳣ���ֱ�Ϊ K a1��K a2�������� NaHSO3��Һ�����Եij�Ҫ����Ϊ_____��(�ú�Ϊ Ka1��Ka2 �Ĵ���ʽ��ʾ)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com