
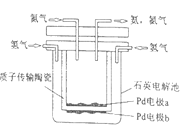
【题目】原电池是将_____能转化成_____能的一种装置。一种利用原电池原理制备NH3的装置如图所示,陶瓷在高温时可以传输H+。该设备中,电极____(填“a”或“b”)作负极,其电极反应式为:_____。当电路中通过1.2mol的电子时,可生成NH3____mol。
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一名同学把4.48 L(已折算成标准状况下)某有机物蒸气在O2中充分燃烧,然后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8 mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
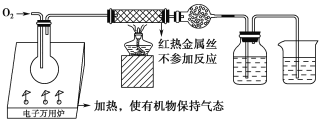
实验结束后发现无水CuSO4变蓝,干燥管和洗气瓶共增重18 g,澄清石灰水变浑浊后又恰好变澄清。请根据实验回答下列问题:
(1)O2要过量的原因是:________________。
(2)若该有机物只含C、H两种元素,且不含任何官能团,也不含脂环,则该有机物的分子式为________,它可能属于________(填序号)。
A.烷烃 B.苯的同系物 C.芳香烃 D.烃的衍生物
该物质可能的结构简式为_____________________。
(3)若该有机物分子中含有一个氧原子,则它可能是哪几类物质?请各举一例,填写在下表中:
物质种类 | 实例(写结构简式) |
_________ | _________ |
_________ | _________ |
_________ | _________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池是一种新型的绿色环保储能电池。其电池总反应为:
![]() 。下列说法正确的是
。下列说法正确的是
A.放电时正极反应为:![]()
B.充电时阴极反应为:![]()
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.充电过程中,H+由阴极区向阳极区迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,实验结束发现试管a中的物质分为三层.对该实验的分析错误的是( )

A. 烧瓶中除发生取代反应可能发生消去反应、氧化还原反应等
B. 产物在a中第一层
C. a中有产物和水还含HBr、CH3CH2OH等
D. b中盛放的酸性KMnO4溶液会褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4和N2一定条件下能直接生成氨:3CH4(g)+2N2(g)![]() 3C(s)+4NH3(g)-Q,700℃时,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如所示。正确的是
3C(s)+4NH3(g)-Q,700℃时,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如所示。正确的是
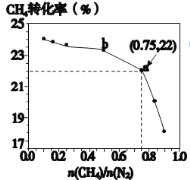
A.n(CH4)/n(N2)越大,CH4的转化率越高
B.n(CH4)/n(N2)不变时,升温,NH3的体积分数会增大
C.b点对应的平衡常数比a点的大
D.a点对应的NH3的体积分数约为13%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷有多种化合物,次磷酸(H3PO2)和次磷酸钠(NaH2PO2)常为化工生产中的还原剂。完成下列填空:
(1)H3PO2是一元中强酸,写出其电离方程式:_______;请将NaH2PO2溶液中的各离子按浓度由大到小的顺序排列:__________。
(2)室温下0.1mol/L的NaH2PO2溶液和0.1mol/L的Na2CO3溶液,pH更大的是_______,其原因是__________。
(3)化学镀银,可利用H3PO2把溶液中的Ag+还原为银的反应,已知该反应中还原剂与氧化剂的物质的量之比为1:4,则氧化产物是_______(填化学式)。
(4)工业上可用白磷(P4)与Ba(OH)2溶液反应生成PH3和Ba(H2PO2)2。写出并配平该反应的化学方程式________,若反应中转移电子6NA,用去还原剂_____mol。再向Ba(H2PO2)2溶液中加入盐酸制备H3PO2,有人说应该用硫酸代替盐酸,请说明用硫酸代替盐酸的优点:_______。
(5)下图是利用电解原理制备H3PO2的示意图(阳离子交换膜和阴离子交换膜分别只允许阳、阴离子通过;已知电极反应为:

阳极 4OH--4e→O2↑+ H2O
阴极 2H+ + 2e→H2↑):
分析在阳极室得到H3PO2原因:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AG=lg![]() ,电离度α=
,电离度α=![]() ×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
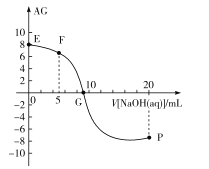
下列说法错误的是( )
A.F点溶液pH<7
B.G点溶液中c(Na+)=c(X-)>c(H+)=c(OH-)
C.V=10时,溶液中c(OH-)<c(HX)
D.常温下,HX的电离度约为1%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol/LCuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是

已知:lg2=0.3,Ksp(ZnS)=3×10-25 mol2/L2。
A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(H+)+c(HS-)+c(H2S)= c(OH-)
C. 该温度下Ksp(CuS)=4×10-36 mol2/L2
D. 向100 mL Zn2+、Cu2+浓度均为10-5 molL-1的混合溶液中逐滴加入10-4 molL-1的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com