
【题目】请阅读下列材料,完成下面小题。
随着社会经济的发展,汽车已进入千家万户,它给人们出行带来方便的同时汽车尾气污染问题也日益突显,汽车尾气中含NO、NO2、CO2、SO2和固体悬浮颗粒等。用活性炭还原处理氮氧化物是一种实用的氮氧化物转化方法:C(s)+2NO(g) ![]() N2(g)+CO2(g),可实现氮氧化物无害转化。
N2(g)+CO2(g),可实现氮氧化物无害转化。
【1】下列环境问题与汽车尾气的大量排放无关的是
A.酸雨B.温室效应C.PM2.5超标D.白色污染
【2】该反应属于化学基本反应类型中的
A.化合反应B.分解反应C.置换反应D.复分解反应
【3】该反应属于氧化还原反应,下列说法正确是
A.C元素被还原B.NO得到电子C.NO发生氧化反应D.CO2是氧化剂
【4】关于该反应下列说法不正确的是
A.升高温度能够加快反应速率
B.降低NO浓度能够减慢反应速率
C.使用合适的催化剂可以加快反应速率
D.加入足量的炭粉可以使NO 100%转化
【答案】
【1】D
【2】C
【3】B
【4】D
【解析】
【1】汽车尾气中含NO、NO2、CO2、SO2和固体悬浮颗粒等,NO、NO2和SO2可导致酸雨, CO2会引起温室效应,固体悬浮颗粒使得PM2.5超标,白色污染由废弃塑料如聚乙烯、聚氯乙烯等引起,与汽车尾气无关;
答案选D;
【2】C(s)+2NO(g) ![]() N2(g)+CO2(g)是1种单质和1种化合物反应生成另一种单质和另一种化合物,属于置换反应;
N2(g)+CO2(g)是1种单质和1种化合物反应生成另一种单质和另一种化合物,属于置换反应;
答案选C;
【3】反应C(s)+2NO(g) ![]() N2(g)+CO2(g)中,碳元素化合价升高,C是还原剂,失去电子,发生氧化反应,C元素被氧化;氮元素化合价降低,NO是氧化剂,得到电子,发生还原反应;
N2(g)+CO2(g)中,碳元素化合价升高,C是还原剂,失去电子,发生氧化反应,C元素被氧化;氮元素化合价降低,NO是氧化剂,得到电子,发生还原反应;
答案选B;
【4】A. 升高温度能够加快反应速率,A正确;
B. 降低反应物NO浓度,能够减慢反应速率,B正确;
C. 使用合适的催化剂可以加快反应速率,C正确;
D. 反应是可逆的,NO不可能100%转化,D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】用如图所示的实验装置制备少量乙酸乙酯。请回答问题,将所选方法的数字代号填在括号中:
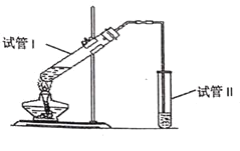
(1)试管Ⅰ中盛有由2mL浓硫酸、3mL乙醇、2mL冰醋酸组成的反应混合液,其中浓硫酸的作用是________。
①催化剂和吸水剂,②脱水剂
(2)试管Ⅱ中的导管口为什么要在液面之上?________。
①防止倒吸,②有利于气体导出
(3)试管Ⅱ中的Na2CO3溶液的主要作用是(不定项)________。
①降低乙酸乙酯在溶液中的溶解度;
②除去挥发出的乙酸;
③溶解挥发出的乙醇。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醛类是香料中重要的一族,铃兰醛具有令人愉快的香味。以下是合称铃兰醛的一种路线:
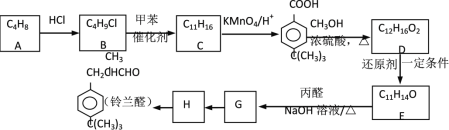
已知:① R1―CHO + R2―CH2―CHO ![]() R1―CH=C―CHO
R1―CH=C―CHO
② R―Cl +![]()
![]()
![]() + HCl
+ HCl
完成下列填空:
(1)写出A的名称_____________。
(2)写出结构简式:C_______;E_________。
(3)化合物M是G的芳香族同分异构体,M符合以下条件:
①能发生银镜反应;②在苯环的1,3,5位有三个侧链,其中两个烃基是C2H3和C4H9,则符合条件M的同分异构体共_______种。
(4)写出H生成铃兰醛的化学方程式:_______。
(5)E向G转化的过程中,常有分子式为C17H22O的副产物K产生。K的结构简式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.02mol/LMOH溶液逐滴滴入100mL0.01mol/LHA溶液中,溶液pH随滴入MOH溶液的体积变化如图所示。若忽略溶液混合时的体积变化,下列叙述正确的是( )
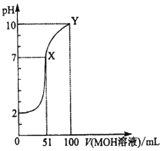
A.温度不变,滴入MOH溶液的过程中水的电离程度不变
B.X点MOH过量,故溶液中c(M+)>c(A-)
C.HA为弱酸,MOH为强碱
D.Y点的c(MOH)+c(M+)=0.01mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是环境污染物,研究氮氧化物转化有重要的意义。回答下列问题:
(1)催化转化器可使汽车尾气反应而转化:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH
N2(g)+2CO2(g) ΔH
已知:2C(s)+O2(g)=2CO(g) ΔH1=akJ·mol-1;
C(s)+O2(g)=CO2(g) ΔH2=bkJ·mol-1;
N2(g)+O2(g)=2NO(g) ΔH3=ckJ·mol-1
ΔH=__kJ·mol-1(用含a、b、c的代数式表示);
(2)T℃时,将等物质的量的NO和CO充入容积为1L的密闭容器中发生尾气转化反应,容器中NO物质的量随时间变化如图所示。
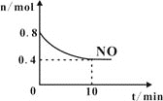
①T℃时,该化学反应的平衡常数K=___。
②下列事实能判断汽车尾气转化反应达到到化学平衡状态的是___;
A.体系中NO的转化率和CO的转化率相等 B.气体的密度不再变化
C.NO消耗速率等于N2消耗速率的2倍 D.混合气体平均相对分子质量不再变化
③已知汽车尾气转化反应的ΔH<0。10min后,改变下列示意图横坐标对应的反应条件,纵坐标对应的量变化关系不正确的是___。(填序号)
a.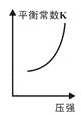 b.
b.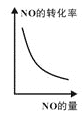 c.
c.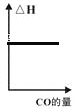 d.
d.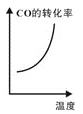
(3)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)![]() 2I(g)(快反应)
2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。
下列表述不正确的是___(填标号)。
A.IO为反应的中间产物
B.第二步活化能比第三步小
C.第二步对总反应速率起决定作用
D.N2O分解反应中,k值与是否含碘蒸气无关
(4)碱吸收、碳还原是目前工业生产中处理氮氧化物的常用方法。
①碱吸收的常见产物为NaNO2。常温下,pH=8的NaNO2溶液中c(Na+)-c(NO2-)=___mol·L-1(用精确值表示);
②碳还原法是在高温条件下将NO与NO2混合气体与焦炭反应,生成CO2和N2,且物质的量之比为4:3,写出该方法的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),
如图所示。导致该现象的主要原因是液滴下面的氧气
含量比液滴边缘少。下列说法正确的是

A.(a)区腐蚀比(b)区腐蚀严重
B.该过程发生了化学反应:4Fe+3O2=2Fe2O3
C.该过程是析氢腐蚀,负极反应为:Fe-2e- =Fe2+
D.该过程为吸氧腐蚀,正极反应为:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物
质的量变化如图-1所示;若保持其他条件不变,温度分别为T1和T2,Y的体积百分含量与时间的关系如图-2所示。下列分析正确的是
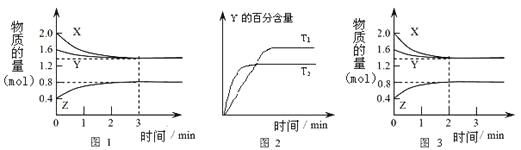
A.容器中发生的反应可表示为:3X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.0~3 min内,v(X)=0.2 molL-1min-1
C.其他条件不变升高温度,v正、v逆都增大,且重新平衡前v正>v逆
D.若改变条件,使反应进程如图-3所示,则改变的条件可能是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫氧化物易引起环境行染,需要悉心研究。
(1)二氧化硫可用于催化氧化制硫酸。硫酸工业中,作为催化剂的 V2O5对反应 I 的催化循环过程经历了Ⅱ、Ⅲ两个反应阶段,如图所示:

写出 V2O5·SO3参加反应Ⅲ的化学方程式_____。
(2)将 2molSO2和 1molO2充入密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)2SO3(g)。平衡时 SO3的体积分数(% )随温度和压强的变化如表所示:
1.0 | 2.0 | 3.0 | |
350 | 54.0 | a | b |
415 | c | 40.0 | d |
550 | e | f | 36.0 |
下列判断正确的是______________
A.b >e
B.415℃、2.0MPa时O2的转化率为60%
C.在一定温度和压强下,加入 V2O5作催化剂能加快反应速率,提高 SO3 的体积分数
D.平衡常数 K(550℃)>K(350℃)
(3)较纯的 SO2,可用于原电池法生产硫酸。图中离子交换膜是___________离子交换膜(填“阴”、“阳”)
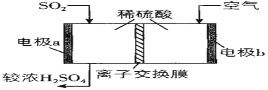
(4)研究发现含碱式硫酸铝的溶液与SO2 结合的方式有2种:其一是与溶液中的水结合。其二是与碱式硫酸铝中的活性Al2O3结合,通过酸度计测定吸收液的pH变化,结果如图所示:

请解释曲线如图变化的原因____
(5)取五等份SO3,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:3SO3(g)(SO3)3(g) △H<0,反应相同时间后,分别测定体系中SO3的百分含量,并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是________________
A.  B.
B.  C.
C.  D.
D. 
(6)用 Na2SO3 溶液作为吸收液吸收 SO2 时,产物为 NaHSO3,已知亚硫酸的两级电离平衡常数分别为 K a1、K a2。则常温下 NaHSO3溶液显酸性的充要条件为_____。(用含为 Ka1、Ka2 的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某有机物分子中C、H、O、N四种原子的成键方式示意图(短线表示单键或者双键)。下列关于该有机物的说法正确的是
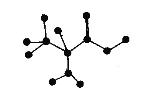
A.在一定条件下,可以通过聚合反应生成高分子化合物
B.分子式为C3H6NO2
C.能和NaOH溶液反应,但不能和盐酸溶液反应
D.不能和NaHCO3溶液反应生成CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com