
 (1)同一物质存在气态的熵值最大,液态的熵值次之,固态的熵值最小.若同温同压下,一个反应生成物气体的体积等于反应物气体的体积就可粗略认为该反应的熵变为0.某化学兴趣小组,专门研究了氧族元素及其某些化学物的部分性质.所查资料如下:
(1)同一物质存在气态的熵值最大,液态的熵值次之,固态的熵值最小.若同温同压下,一个反应生成物气体的体积等于反应物气体的体积就可粗略认为该反应的熵变为0.某化学兴趣小组,专门研究了氧族元素及其某些化学物的部分性质.所查资料如下:分析 (1)从图象获取反应热的信息;
(2)氢氧根离子先与氢离子反应,再与铝离子反应,然后与铵根离子反应,最后与Al(OH)3反应;
(3)析出沉淀时,AgCl溶液中c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$,AgBr溶液中c(Ag+)=$\frac{Ksp(AgBr)}{c(B{r}^{-})}$,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{2-})}}$,c(Ag+)越小,先生成沉淀;
(4)依据电离平衡常数判断出的酸性H2CO3 >HClO>HCO3-;依据酸性强弱分析反应产物.
解答 解:(1)从图象可知,S与H2的△H<0,Te和H2反应的△H>0,且反应的熵变约为0,不能自发进行,
故答案为:放出;由图可知Te和H2反应的是吸热反应,即△H>0,熵变约为0,所以该反应不自发;
(2)氢氧根离子先与氢离子反应①H++OH-═H2O,再与铝离子反应②Al3++3OH-═Al(OH)3↓,再与铵根离子反应③NH4++OH-═NH3•H2O,最后与Al(OH)3反应④Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O;
(3)AgCl溶液中c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{1.56×1{0}^{-10}}{0.01}$mol/L=1.56×10-8mol/L,AgBr溶液中c(Ag+)=$\frac{Ksp(AgBr)}{c(B{r}^{-})}$=$\frac{7.7×1{0}^{-13}}{0.01}$mol/L=7.7×10-11mol/L,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{2-})}}$=$\sqrt{\frac{9.0×1{0}^{-12}}{0.01}}$mol/L=3×10-5,c(Ag+)越小,则越先生成沉淀,所以种阴离子产生沉淀的先后顺序为Br-、Cl-、CrO42-;
故答案为:Br-、Cl-、CrO42-.
(4)①将少量的氯气通入到过量的碳酸钠溶液中,氯气和水反应生成的盐酸反应生成碳酸氢钠,次氯酸酸性强于碳酸氢根离子,反应生成碳酸氢钠,反应的离子方程式为:Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO-,
故答案为:Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO-;
②氯气和碳酸钠按照1:1的比例恰好反应,生成的盐酸恰好和碳酸钠反应生成碳酸氢钠,次氯酸不参与反应,反应的离子方程式为:Cl2+CO32-+H2O═HCO3-+Cl-+HClO,
故答案为:Cl2+CO32-+H2O═HCO3-+Cl-+HClO.
点评 本题考查反应的自发性、离子方程式的书写、难溶电解质的溶解平衡问题等知识点.注意碘和氢气的反应特点及等效平衡的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 强电解质溶液的导电能力一定比弱电解质溶液强 | |
| B. | 因醋酸是弱电解质,盐酸是强电解质,因而中和等体积、等物质的量浓度的醋酸和盐酸时,盐酸消耗的NaOH比醋酸多 | |
| C. | NaHCO3溶于水,溶液中存在电离平衡 | |
| D. | 物质的量浓度相同的磷酸钠溶液和磷酸溶液中C(PO43-)相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg | B. | Mg | C. | $\frac{M}{6.02×1{0}^{23}}$g | D. | Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.
碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.| 时间/min | 0 | 10 | 20 | 30 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锅炉水垢中的CaSO4经饱和碳酸钠溶液浸泡可转化为CaCO3 | |
| B. | 常温下,在含有Ag+和Cl-的溶液中,Ag+和Cl-浓度之积是个常数 | |
| C. | 当醋酸达到电离平衡后,改变某条件电离平衡向正反应方向移动,则溶液的导电能力一定变强 | |
| D. | 将浓度为0.1 mol/L的HF溶液加水不断稀释,溶液$\frac{c({F}^{-})}{c({H}^{+})}$始终保持增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 0min | 5min | 10min | |
| CO | 0.01 | 0.0056 | |
| H2O | 0.01 | 0.0156 | |
| CO2 | 0 | 0.0044 | |
| H2 | 0 | 0.0044 |
| A. | 0~5min 时用H2O(g)表示的平均反应速率为1.2×10-3 mol/( L.min) | |
| B. | 5min~10min 改变的条件是再加入了0.1mol H2O(g) | |
| C. | 200℃时,若向容器中充入0.01mol CO(g)、0.01mol H2O(g)、0.01molCO2(g)、0.01molH2(g),达平衡时,CO(g)为1.2×10-3mol/L | |
| D. | 300℃时,若向容器中充入0.01mol CO(g)、0.01mol H2O(g)、0.02molCO2(g)、0.02molH2(g),则开始反应时ν(正)<ν(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,向含有AgCl固体的饱和溶液,加少量水稀释,c(Ag+)和Ksp(AgCl)均保持不变 | |
| B. | pH=5的CH3COOH与CH3COONa的混合溶液中:c(Na+)>c(CH3COO-) | |
| C. | 将0.2mol/LCH3COOH溶液和0.1mol/LNaOH溶液等体积混合,则反应后的混合溶液中:2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH) | |
| D. | 将水加热煮沸,能促进水的电离,Kw增大,pH增大,溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 化学反应过程中总是伴随着能量的变化,能量间可以相互转化.
化学反应过程中总是伴随着能量的变化,能量间可以相互转化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
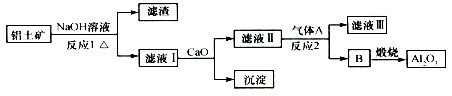
| A. | 气体A一定为HCl | B. | 滤液Ⅰ中溶质可能含NaAlO2 | ||
| C. | 沉淀的主要成分不是硅酸钙 | D. | 反应1、反应2均是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com