
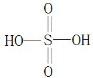
(10分)前四周期元素X、Y、Z、M、N原子序数依次增大,其中有两种是金属元素,X单质是密度最小的物质,Y原子最外层电子数是次外层的两倍,Z单质是大气中的一种气体,豆科植物常温下能将之转化为化合物。M元素的p电子总数比s电子总数多1,N是一种生命元素,人体缺少该元素会发生贫血,使人脸色萎黄。
请根据上述信息,回答下列问题:
(1)写出M原子基态电子排布式 。
(2)直线型分子Y2Z2中所有原子都达到8电子稳定结构,其中δ键、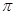 键之比是 。
键之比是 。
(3)上述五种元素能形成的晶体类型有 (填编号)。
①原子晶体②分子晶体③离子晶体④金属晶体
(4)已知:298 K时固体M在氧气中燃烧生成1 mol M203固体时,放出热量1676.2 kJ;固
体N在氧气中燃烧生成1 mol N304固体时,放出热量1118.4 kJ。请写出298 K时,由M
单质与Z304反应的热化学方程式:
(5)在沸水中加入N的某高价盐饱和溶液可以得到一种红褐色的液体,向该液体中逐滴加入含Z的最高价氧化物的水化物溶液直至过量的过程中发生的现象是____ 。
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
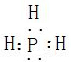

查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)前四周期元素X、Y、Z、M、N原子序数依次增大,其中有两种是金属元素,X单质是密度最小的物质,Y原子最外层电子数是次外层的两倍,Z单质是大气中的一种气体,豆科植物常温下能将之转化为化合物。M元素的p电子总数比s电子总数多1,N是一种生命元素,人体缺少该元素会发生贫血,使人脸色萎黄。
请根据上述信息,回答下列问题:
(1)写出M原子基态电子排布式 。
(2)直线型分子Y2Z2中所有原子都达到8电子稳定结构,其中δ键、![]() 键之比是 。
键之比是 。
(3)上述五种元素能形成的晶体类型有 (填编号)。
①原子晶体②分子晶体③离子晶体④金属晶体
(4)已知:298 K时固体M在氧气中燃烧生成1 mol M203固体时,放出热量1676.2 kJ;固
体N在氧气中燃烧生成1 mol N304固体时,放出热量1118.4 kJ。请写出298 K时,由M
单质与Z304反应的热化学方程式:
(5)在沸水中加入N的某高价盐饱和溶液可以得到一种红褐色的液体,向该液体中逐滴加入含Z的最高价氧化物的水化物溶液直至过量的过程中发生的现象是____ 。
查看答案和解析>>
科目:高中化学 来源:2011-2012年重庆西南大学附中高二下学期期中考试化学试卷(带解析) 题型:填空题
(12分)前四周期元素X、Y、Z、W核电荷数依次增加,核电荷数之和为58;Y 原子的M层p轨道有3个未成对电子;Z与Y同周期,且在该周期中电负性最大;W原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶2。
(1)X的元素符号为_______,Z元素位于周期表第_______周期第________族。
(2)Y与X形成共价化合物A,Z与X形成共价化合物B,A与B还原性较强的是________(写分子式)。
(3)Z的最高价氧化物的水化物的化学式为________________。
(4)12.4 g单质Y4与0.3 mol O2在一定条件下恰好完全反应生成0.1 mol化合物C,一个C分子中所含有的 键数目为 。
键数目为 。
(5)含W元素的最高化合价的含氧酸根离子是___________,该含氧酸根离子在分析化学中有重要作用,请写出在酸性条件下该含氧酸根离子与Fe2+反应的离子方程式:
______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省淮北市高三第一次模拟考试化学试卷 题型:填空题
(10分)前四周期元素X、Y、Z、M、N原子序数依次增大,其中有两种是金属元素,X单质是密度最小的物质,Y原子最外层电子数是次外层的两倍,Z单质是大气中的一种气体,豆科植物常温下能将之转化为化合物。M元素的p电子总数比s电子总数多1,N是一种生命元素,人体缺少该元素会发生贫血,使人脸色萎黄。
请根据上述信息,回答下列问题:
(1)写出M原子基态电子排布式 。
(2)直线型分子Y2Z2中所有原子都达到8电子稳定结构,其中δ键、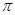 键之比是 。
键之比是 。
(3)上述五种元素能形成的晶体类型有 (填编号)。
①原子晶体②分子晶体③离子晶体④金属晶体
(4)已知:298 K时固体M在氧气中燃烧生成1 mol M203固体时,放出热量1676.2 kJ;固
体N在氧气中燃烧生成1 mol N304固体时,放出热量1118.4 kJ。请写出298 K时,由M
单质与Z304反应的热化学方程式:
(5)在沸水中加入N的某高价盐饱和溶液可以得到一种红褐色的液体,向该液体中逐滴加入含Z的最高价氧化物的水化物溶液直至过量的过程中发生的现象是____ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com