
【题目】下列叙述中,错误的是( )
A.摩尔是物质的量的单位
B.36g水中含氢原子数目为4NA(NA表示阿伏加德罗常数的值)
C.在0.5molNa2SO4中,含有的Na+数约是6.02×1023
D.等质量的O2与O3,所含氧原子数之比为3:2
科目:高中化学 来源: 题型:
【题目】某中间体M(2—甲基丙氨酸)的结构简式如图所示。下列有关M的说法错误的是

A.分子式为![]()
B.1molM与NaOH溶液反应,消耗lmolNaOH
C.分子中所有的碳原子不可能处于同一平面
D.与M含有相同官能团的同分异构体有5种![]() 不含本身,不考虑空间异构
不含本身,不考虑空间异构![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)甲烷和氯气在光照条件下发生卤代反应,其反应机理如下:
反应①:![]() △H=242.7kJ·mol-1
△H=242.7kJ·mol-1
反应②:![]() △H=7.5kJ·mol-1
△H=7.5kJ·mol-1
反应③:![]() △H=-112.9kJ·mol-1
△H=-112.9kJ·mol-1
反应②、③反复循环,反应物浓度逐渐降低,自由基逐渐消失,反应停止。
(1)在该反应条件下断裂1mol CH3Cl中C—Cl键,需要吸收的能量为______。
(2)反应②与反应③的反应过程,如下图所示:
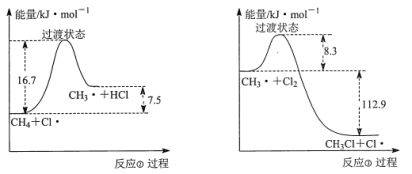
则该条件下,反应②的速率______反应③的速率(填“>”、“<”或“=”)。
(3)根据以上的反应机理,我们可以推测甲烷和氯气在光照条件下反应,除生成CH3Cl、CH2Cl2、CHCl3、CCl4外,还会有乙烷等有机物,原因是______。
(二)煤燃烧排放的SO2和NO2可形成严重的大气污染,某兴趣小组提出利用反应![]() 来处理。
来处理。
(4)在一定温度下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,达到平衡时NO2和SO2的体积之比为1:5,则该温度下平衡常数K为______。
(5)若向绝热恒容密闭容器中通入SO2和NO2,v正随时间变化如下图。下列结论正确的是______。
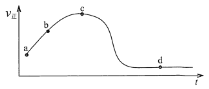
A. a点颜色比b点深
B. c点正反应速率等于逆反应速率
C. 若升高温度,d点SO2的转化率将增大
D. 反应的过程中,容器内气体压强保持不变
E. 若外界条件不发生改变,d点NO2和NO的体积比将保持不变
(6)若用一定浓度的NaClO2溶液(已调节其初始pH为5)充分吸收煤燃烧排放的烟气后,测得溶液中各物质的浓度如下表所示:

其中 NaClO2溶液吸收SO2的主要离子反应方程式为______。
(7)为消除NOx,科学家开发了一种能传导O2-的固态高温陶瓷电池,一极通氨气,另一极通NOx,生成无污染的常见气体和液体。写出该电池的正极反应式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
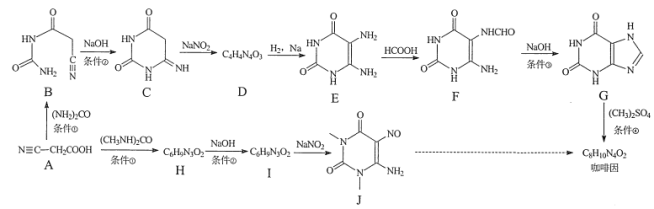
【题目】某研究小组按下列两条线合成咖啡因:
已知:R1-NH-R2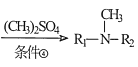 ,请回答:
,请回答:
(1)下列说法正确的是____。
A. 化合物A能与碳酸氢钠反应产生气体
B. 化合物C在酸性条件下水解,加热后有CO2产生
C. 化合物E到F的反应为酯化反应
D. 化合物J的分子式是C6H10N4O3
(2)化合物D的结构简式是______。
(3)写出H→I的化学方程式______。
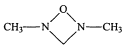
(4)化合物(CH3NH2)2CO的同分异构体的1H—NMR谱显示分子中只有2种化学环境不同的氢原子,符合要求的结构简式如图,除这三种外,还有______。
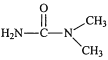 、
、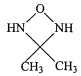 、
、
(5)根据题目所提供的信息,请设计J→咖啡因的合成路线(用流程图表示,无机试剂任选)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
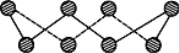
(1)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是______;
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是_______;氮元素的E1呈现异常的原因是________。
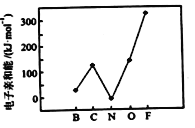
(3)Se原子序数为_______,其核外M层电子的排布式为_________;
(4)H2Se的稳定性比H2S_____________(填“强”或“弱”)。SeO3分子的立体构型为______。
(5)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从原子核外电子结构角度来看,Fe2+ 易被氧化成Fe3+的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组在实验室用如图所示装置制取氨并验证氨的某些性质,请回答。
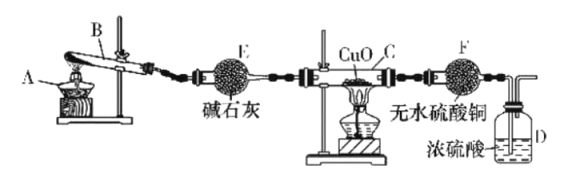
(1)写出此实验中制氨的化学方程式:___。
(2)实验进行一段时间,观察到硬质玻璃管内黑色氧化铜粉末变为红色,盛无水硫酸铜的干燥管内出现蓝色,同时有氮气生成。根据这些现象,写出在硬质玻璃管内发生反应的化学方程式:__,这个反应说明氨具有___(填字母代号)。
A.碱性 B.还原性 C.氧化性 D.不稳定性
(3)装置E的作用是__,装置F的作用是___。E中的碱石灰__(填“能”或“不能”)换成CaCl2。
(4)D中浓硫酸的主要作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CH3COOCH2CH3 与 CH3CH2COOCH3 为同一种物质
B.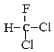 和
和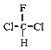 为同一物质
为同一物质
C.CH3CH2CH2CH2CH3 和 CH3CH2CH(CH3)2 互为同素异形体
D.乙醇在浓硫酸作用下迅速加热到 140℃,生成乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
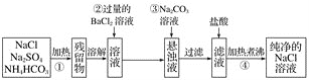
如果此方案正确,那么:
(1)操作①可选择_______仪器。
(2)操作②是否可改为加硝酸钡溶液__________,原因是___________。
(3)进行操作②后,判断硫酸根离子已除尽的方法是_____________。
(4)操作③的目的是_______,不先过滤后加碳酸钠溶液的理由是__________。
(5)操作④的目的是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浓度的氨水中存在平衡:NH3·H2O![]() NH4++OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
NH4++OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
①适当升高温度 ②加入NH4Cl固体 ③通入NH3 ④加入少量盐酸
A.②④B.②③C.①②D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com