
【题目】VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
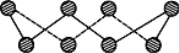
(1)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是______;
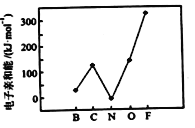
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是_______;氮元素的E1呈现异常的原因是________。
(3)Se原子序数为_______,其核外M层电子的排布式为_________;
(4)H2Se的稳定性比H2S_____________(填“强”或“弱”)。SeO3分子的立体构型为______。
(5)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从原子核外电子结构角度来看,Fe2+ 易被氧化成Fe3+的原因是_________。
【答案】sp3 非金属性增强,得电子时释放的能量依次增大 氮元素2p轨道为半满状态,较稳定,第一亲和能较低 34 3s23p63d10 弱 平面三角形 Fe2+的价电子排布为3d6,失去一个电子成Fe3+为3d5,半满状态稳定
【解析】
(1)在S8中,S原子的价层电子对数为4,由此得出S采用的轨道杂化方式。
(2)除氮元素外,其他元素非金属性越强,第一亲和能E1越大;氮元素的2p轨道半充满,电子能量低,原子稳定。
(3)Se比S多18个电子,由此可得出原子序数及核外M层电子的排布式。
(4)Se比S的非金属性弱,则可得出H2Se与H2S的稳定性关系。SeO3分子中S原子的价层电子对数为3,由此可得出立体构型。
(5)从原子核外轨道中的电子排布,可确定Fe2+易被氧化成Fe3+的原因。
(1)在S8中,S原子的价层电子对数为4,则S采用的轨道杂化方式sp3。答案为:sp3;
(2)除氮元素外,其他元素非金属性越强,第一亲和能E1越大,其原因是非金属性增强,得电子时释放的能量依次增大;氮元素的2p轨道半充满,电子能量低,原子稳定,由此得出氮元素的E1呈现异常的原因是氮元素2p轨道为半满状态,较稳定,第一亲和能较低。答案为:非金属性增强,得电子时释放的能量依次增大;氮元素2p轨道为半满状态,较稳定,第一亲和能较低;
(3)Se比S多1个电子层,多18个电子,由此可得出原子序数为34,核外M层电子的排布式为3s23p63d10。答案为:34;3s23p63d10;
(4)Se比S的非金属性弱,则H2Se的稳定性比H2S弱。SeO3分子中S原子的价层电子对数为3,则立体构型为平面三角形。答案为:弱;平面三角形;
(5)从原子核外轨道中的电子排布,可确定Fe2+易被氧化成Fe3+的原因是Fe2+的价电子排布为3d6,失去一个电子成Fe3+为3d5,半满状态稳定。答案为:Fe2+的价电子排布为3d6,失去一个电子成Fe3+为3d5,半满状态稳定。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】荧光棒的发光原理是利用过氧化氢氧化某草酸二酯产生能量传递给荧光物质发出荧光。该草酸二酯的结构简式如下图所示。下列有关该草酸二酯的说法不正确的是
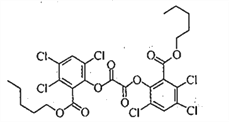
A. 分子中含有一种含氧官能团
B. 苯环上的一溴代物只有一种
C. 可以发生取代反应和加成反应
D. lmol草酸二酯与NaOH溶液反应最多消耗4mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过实验得出的结论正确的是
A.某溶液中加入酸性KMnO4溶液褪色,则原溶液一定含有I-
B.某固体试样加水溶解,取上层清液,加KSCN溶液出现红色,原固体中一定含Fe3+
C.通过元素分析测定某无机固体样品的组成是MgH2C2O6,该固体不可能是碱式碳酸镁
D.某碱性水样滴加稀盐酸无沉淀,再加BaCl2溶液,出现白色沉淀,则原水样中一定含![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化镁晶体在加热时会发生如下变化:![]() ;
;![]() 。研究人员称取氯化镁晶体ag,经加热后得到固体bg。
。研究人员称取氯化镁晶体ag,经加热后得到固体bg。
已知:
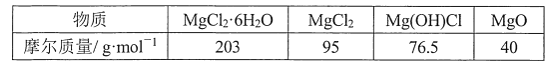
(1)若bg固体为等物质的量的![]() 、MgO混合物,则a与b的关系是____(用分数表示)。
、MgO混合物,则a与b的关系是____(用分数表示)。
(2)若在干燥的HCl气流中加热,得到MgCl2、![]() 的固体
的固体![]() ,则它们的物质的量之比为____。
,则它们的物质的量之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾(KMnO4)是常用的氧化剂。以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体的操作流程如下:
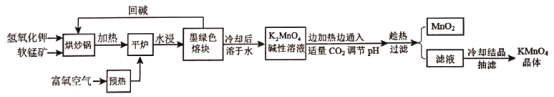
相关资料:①物质溶解度

②锰酸钾[K2MnO4]
外观性状:墨绿色结晶。其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色。
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性中,MnO42-会发生岐化反应。
试回答下列问题:
(1)烘炒前,混配KOH和软锰矿固体,将软锰矿粉碎,其作用是_____,上述流程中趁热过滤的目的是___。
(2)请写出实验中通入适量CO2时体系中可能发生反应的离子方程式:____。
(3)下列有关上述流程及操作说法正确的是_____。
A. 平炉中发生的反应中MnO2的作用是氧化剂
B. 流程中CO2用醋酸溶液代替,得到的产品纯度更高,而不能用盐酸和硫酸代替
C. 抽滤前,应先将滤纸放入布氏漏斗中,微开水龙头,使滤纸紧贴漏斗的瓷板上
D. 抽滤完毕,先断开水泵与吸滤瓶间的橡皮管,然后关闭水龙头
(4)洗涤KMnO4晶体最好的试剂是______。
A. 无水乙醇 B. 乙醇水溶液 C. 氢氧化钾溶液 D. 冷水
(5)晶体干燥时,温度控制在80℃为宜,温度不宜过高的理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A.摩尔是物质的量的单位
B.36g水中含氢原子数目为4NA(NA表示阿伏加德罗常数的值)
C.在0.5molNa2SO4中,含有的Na+数约是6.02×1023
D.等质量的O2与O3,所含氧原子数之比为3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
A.80 g硝酸铵中含有氮原子数为NA
B.0.1 molN5+离子中所含的电子数为3.4NA
C.1 mol甲烷和NA个甲烷分子的质量相等
D.16 g氧气和16 g臭氧所含的原子数均为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物溶解后的溶液可能含有Na+、K+、![]() 、
、![]() 、
、![]() 中的若干种,取该溶液进行连续实验,实验过程如下(所加试剂均过量,气体全部逸出)。下列说法不正确的是
中的若干种,取该溶液进行连续实验,实验过程如下(所加试剂均过量,气体全部逸出)。下列说法不正确的是
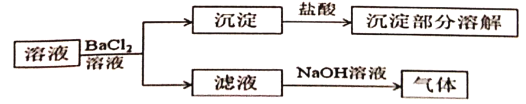
A.原固体可能是硫酸铵和碳酸钠B.原固体可能是碳酸铵和硫酸钠
C.原固体不可能是硫酸铵和碳酸钾D.原固体不可能是碳酸钾和硫酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固态或气态碘分别与氢气反应的热化学方程式如下:
①![]()
![]()
②![]()
![]()
下列判断不正确的是( )
A.①中的![]() 为固态,②中的
为固态,②中的![]() 为气态
为气态
B.①的反应物总能量比②的反应物总能量高
C.反应①的产物与反应②的产物热稳定性相同
D.1mol 固态碘完全升华会吸热35.96kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com