
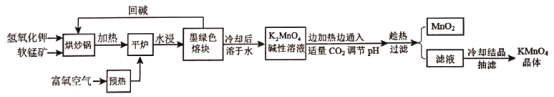
【题目】高锰酸钾(KMnO4)是常用的氧化剂。以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体的操作流程如下:
相关资料:①物质溶解度

②锰酸钾[K2MnO4]
外观性状:墨绿色结晶。其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色。
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性中,MnO42-会发生岐化反应。
试回答下列问题:
(1)烘炒前,混配KOH和软锰矿固体,将软锰矿粉碎,其作用是_____,上述流程中趁热过滤的目的是___。
(2)请写出实验中通入适量CO2时体系中可能发生反应的离子方程式:____。
(3)下列有关上述流程及操作说法正确的是_____。
A. 平炉中发生的反应中MnO2的作用是氧化剂
B. 流程中CO2用醋酸溶液代替,得到的产品纯度更高,而不能用盐酸和硫酸代替
C. 抽滤前,应先将滤纸放入布氏漏斗中,微开水龙头,使滤纸紧贴漏斗的瓷板上
D. 抽滤完毕,先断开水泵与吸滤瓶间的橡皮管,然后关闭水龙头
(4)洗涤KMnO4晶体最好的试剂是______。
A. 无水乙醇 B. 乙醇水溶液 C. 氢氧化钾溶液 D. 冷水
(5)晶体干燥时,温度控制在80℃为宜,温度不宜过高的理由是___。
【答案】增大接触面积,加快反应速度 防止高锰酸钾析出 3MnO42-+3CO2+2OH-=2MnO4-+MnO2↓+H2O+3CO32- BD D 温度过高,产品受热分解
【解析】
软锰矿与氢氧化钾在烘炒锅里和氧气反应生成了墨绿色熔块,可得到K2MnO4,冷却溶于水后得到K2MnO4的碱性溶液,通入CO2调节pH,离子反应为3MnO42-+3CO2+2OH-=2MnO4-+MnO2↓+H2O+3CO32- ,趁热过滤、冷却结晶可得到KMnO4,据此分析。
(1)将软锰矿粉碎,增大了接触面积,能加快反应速率;KMnO4的溶解度随温度的升高而升高,因此需要趁热过滤;
(2)通入适量的CO2时与K2MnO4碱性溶液反应得到MnO2和KMnO4,离子反应为:3MnO42-+3CO2+2OH-=2MnO4-+MnO2↓+H2O+3CO32-;
(3)A.平炉反应中锰元素化合价升高,失电子,做还原剂,A项错误;
B.二氧化碳用醋酸代替,醋酸钾的溶解度大于碳酸钾,远大于高锰酸钾,降温结晶时不会随着高锰酸钾一起结晶出来,会使得到的产物纯度更高,如 CO2用硫酸溶液代替,硫酸钾的溶解度和高锰酸钾接近,降温时会和高锰酸钾一起析出,使得到的产品不纯,所以不能用盐酸和硫酸代替二氧化碳,B项正确;
C. 抽滤前,应先将滤纸放入布氏漏斗中,用蒸馏水润湿,微开水龙头,使滤纸紧贴漏斗的瓷板上,C项错误;
D. 抽滤完毕,先断开水泵与吸滤瓶间的橡皮管,然后关闭水龙头,D项正确;
答案选BD。
(4)高锰酸钾的溶解度随温度的降低而减低,因此洗涤KMnO4晶体最好的试剂是冷水;
(5)由于温度过高晶体会受热分解,故应把温度控制在80℃。


科目:高中化学 来源: 题型:
【题目】合成氨所需的氢气可用煤和水作原料经过多步反应制得,其中的一步反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H< 0,反应到达平衡后,为提高CO的转化率,下列措施中正确的是( )
CO2(g)+H2(g) △H< 0,反应到达平衡后,为提高CO的转化率,下列措施中正确的是( )
A. 增加压强B. 降低温度或增大H2O(g)的浓度
C. 增大CO的浓度D. 更换催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,1L0.1mol·L-1的NaOH溶液中缓慢通入CO2,溶液的pH随CO2的物质的量变化如下图所示(实验过程中溶液体积变化忽略不计),下列说法正确的是
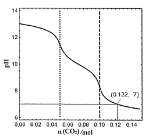
A.在整个过程中,溶液中一定不存在![]()
B.![]() 时,
时,![]()
C.当![]() 时,溶液中不存在H2CO3分子
时,溶液中不存在H2CO3分子
D.当![]() 时,一定有
时,一定有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() 的系统名称是_________;
的系统名称是_________;
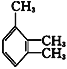 的系统名称为__________。
的系统名称为__________。
(2)2,4-二甲基-3-乙基戊烷的结构简式是_____,1mol该烃完全燃烧生成二氧化碳和水,需消耗氧气_______mol。
(3)键线式![]() 表示的物质的结构简式是__________________。
表示的物质的结构简式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是只含碳、氢、氧三元素的有机物,是高效的抗疟药,为无色针状晶体,易溶于乙醚中,在水中几乎不溶,熔点为156~157℃,已知乙醚沸点为35℃,从青蒿中提取青蒿素的方法之一是以萃取原理为基础,以乙醚浸取法的主要工艺如图所示:
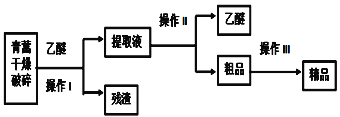
回答下列问题:
(1)选用乙醚浸取青蒿素的原因是______。
(2)操作I需要的玻璃仪器主要有:烧杯、玻璃棒和________ ,操作Ⅱ的名称是__________,操作Ⅲ利用青蒿素和杂质在同一溶剂中的溶解性差异及青蒿素溶解度随温度变化较大的原理提纯,这种方法是______________。
(3)通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成,如图所示的是用燃烧法确定青蒿素分子式的装置:
A. 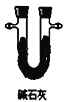 B.
B. 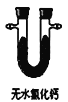 C.
C. 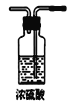 D.
D.  E.
E. 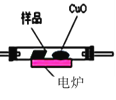
①按上述所给的测量信息,装置的连接顺序应是_____________。(装置可重复使用)
②青蒿素样品的质量为28.2g,用连接好的装置进行试验,称得A管增重66g,B管增重19.8g,则测得青蒿素的最简式是_____________。
③要确定该有机物的分子式,还必须知道的数据是_________,可用__________仪进行测定。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是______;
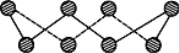
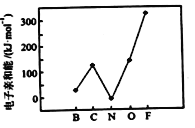
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是_______;氮元素的E1呈现异常的原因是________。
(3)Se原子序数为_______,其核外M层电子的排布式为_________;
(4)H2Se的稳定性比H2S_____________(填“强”或“弱”)。SeO3分子的立体构型为______。
(5)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从原子核外电子结构角度来看,Fe2+ 易被氧化成Fe3+的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.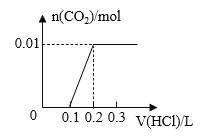 B.
B.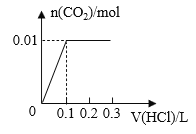
C.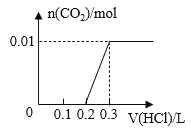 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异丁烷脱氢制异丁烯反应为:![]() △H1=+124kJ·mol-1,副反应为裂解反应:
△H1=+124kJ·mol-1,副反应为裂解反应:![]() △H2=+84kJ·mol-1,异丁烷的转化率(%)随温度和压强的变化如图,下列说法不正确的是
△H2=+84kJ·mol-1,异丁烷的转化率(%)随温度和压强的变化如图,下列说法不正确的是
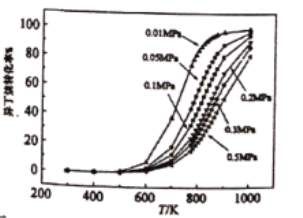
A.由图可知,600~1000K范围内,温度不变,压强增大,异丁烷脱氢反应的转化率降低
B.在不同温度、压强下,转化相同物质的量的异丁烷所需要的时间相等
C.使用催化剂可以加快反应速率,从而缩短反应达到平衡所需的时间
D.开发合适的催化剂,有效抑制副反应的发生,可提高异丁烯的选择性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净碳酸氢铵![]() 置于特制恒容的真空容器中(固体试剂体积忽略不计),一定温度下使其达到分解平衡:
置于特制恒容的真空容器中(固体试剂体积忽略不计),一定温度下使其达到分解平衡:![]() 。
。
下列能够说明该分解反应已经达到化学平衡的是( )
A.密闭容器中混合气体的平均摩尔质量不变
B.密闭容器中![]() 体积分数不变
体积分数不变
C.密闭容器中固体的质量不再发生变化
D.三种气体的生成速率之比为1:1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com