
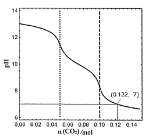
【题目】常温下,1L0.1mol·L-1的NaOH溶液中缓慢通入CO2,溶液的pH随CO2的物质的量变化如下图所示(实验过程中溶液体积变化忽略不计),下列说法正确的是
A.在整个过程中,溶液中一定不存在![]()
B.![]() 时,
时,![]()
C.当![]() 时,溶液中不存在H2CO3分子
时,溶液中不存在H2CO3分子
D.当![]() 时,一定有
时,一定有![]()
【答案】D
【解析】
1L0.1molL-1的NaOH溶液中缓慢通入CO2时,当通入0.05molCO2时两者恰好完全反应生成Na2CO3,当通入0.1molCO2时,两者恰好完全反应生成NaHCO3;
A.当通入的CO2为![]() mol时,剩余的NaOH和生成的Na2CO3的物质的量恰好相同,而CO32-能水解生成OH-,故当通入的二氧化碳的量稍多于
mol时,剩余的NaOH和生成的Na2CO3的物质的量恰好相同,而CO32-能水解生成OH-,故当通入的二氧化碳的量稍多于![]() mol时,溶液中可能会存在c(OH-)=c(CO32-),故A错误;
mol时,溶液中可能会存在c(OH-)=c(CO32-),故A错误;
B.当通入0.1molCO2时,两者恰好完全反应生成NaHCO3,而pH=7时,通入的CO2的物质的量为0.022mol,此溶液中含NaHCO3、CO2和H2CO3,由于HCO3-能电离且能水解,H2CO3能部分电离,故根据物料守恒可知n(CO32-)+n(H2CO3)+n(CO2)+n(HCO3-)=0.022mol,故B错误;
C.当n(CO2)=0.05mol时,两者恰好完全反应生成Na2CO3,CO32-能水解出H2CO3分子,含故溶液中含碳酸分子,故C错误;
D.当n(CO2)=0.05mol时,两者恰好完全反应生成Na2CO3,根据物料守恒可知有c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故有有c(Na+)>c(CO32-)+c(HCO3-),故D正确;
故答案为D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】25℃时,将pH均为2 的HCl与HX 的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法不正确的是
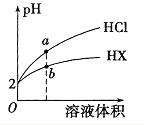
A. a、b两点: c(X-) < c(Cl-) B. 溶液的导电性: a < b
C. 稀释前,c(HX) > 0.01mol/L D. 溶液体积稀释到10倍,HX 溶液的pH < 3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.3 molMnO2和100mL 12 mol/L的浓盐酸混合后缓慢加热,充分反应后向剩余的溶液中加入足量的AgNO3溶液,生成AgCl沉淀的物质的量为(不考虑HCl的挥发)( )
A.等于0.6molB.小于0.6mol
C.大于0.6mol,小于1.2molD.等于1.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,某FeCl3溶液的pH=2,则由水电离产生的总c(OH-)=____________;用离子方程式表示FeCl3溶液用于净水的原因____________________________________。
(2)已知NaHSO4在水中的电离方程式NaHSO4=Na++H++SO42-。在NaHSO4溶液中c(H+)___________c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH__________7。
(3)将0.02mol/LNa2SO4溶液与某浓度BaCl2溶液等体积混合,则生成BaSO4沉淀所需原BaCl2溶液的最小浓度为_________________________________。(已知Ksp(BaSO4)=1.1×10-10)
(4)一定温度下,测得某纯水的pH为6.5。此时水的离子积常数Kw为_______;若在此纯水中加一定量Ba(OH)2固体,配制成0.005mol·L-1的Ba(OH)2溶液,保持原温度,其溶液的pH为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取氯化铁粉末所需装置如下,已知氯化铁粉末很容易吸水生成结晶化合物:FeCl3+6H2O=FeCl3·6H2O。
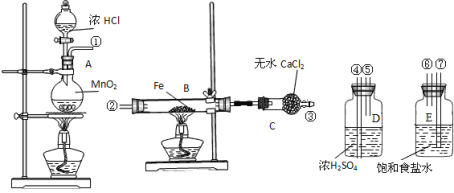
(1)按照气体流向从左到右顺序连接仪器应是①接_____,____接______,____接_______。
(2)烧瓶A中发生的反应_________________,B中反应的现象是____________。
(3)容器D的作用是_______,容器E的作用是_________。
(4)实验时应先点燃__处(填“A”或“B”)的酒精灯,理由是___________________________。
(5)这套实验装置是否完整?___(填“是”或“否”),若不完整,还须补充___________装置(若第一问填“是”,则此问不需要作答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过实验得出的结论正确的是
A.某溶液中加入酸性KMnO4溶液褪色,则原溶液一定含有I-
B.某固体试样加水溶解,取上层清液,加KSCN溶液出现红色,原固体中一定含Fe3+
C.通过元素分析测定某无机固体样品的组成是MgH2C2O6,该固体不可能是碱式碳酸镁
D.某碱性水样滴加稀盐酸无沉淀,再加BaCl2溶液,出现白色沉淀,则原水样中一定含![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,氯水中部分含氯微粒的物质的量浓度随pH的变化趋势如图所示。下列叙述正确的是
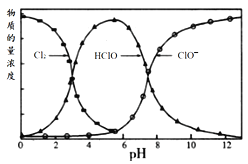
A.pH=1的新制氯水中,c(Cl2)>c(HClO)>c(ClO-)
B.随着pH增大,溶液的颜色加深
C.当pH=10时,溶液中的含氯微粒只有ClO-
D.向pH=4的氯水中加入NaOH溶液,只发生化学反应:HClO+NaOH=NaClO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾(KMnO4)是常用的氧化剂。以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体的操作流程如下:
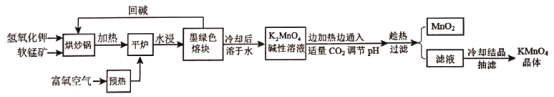
相关资料:①物质溶解度

②锰酸钾[K2MnO4]
外观性状:墨绿色结晶。其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色。
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性中,MnO42-会发生岐化反应。
试回答下列问题:
(1)烘炒前,混配KOH和软锰矿固体,将软锰矿粉碎,其作用是_____,上述流程中趁热过滤的目的是___。
(2)请写出实验中通入适量CO2时体系中可能发生反应的离子方程式:____。
(3)下列有关上述流程及操作说法正确的是_____。
A. 平炉中发生的反应中MnO2的作用是氧化剂
B. 流程中CO2用醋酸溶液代替,得到的产品纯度更高,而不能用盐酸和硫酸代替
C. 抽滤前,应先将滤纸放入布氏漏斗中,微开水龙头,使滤纸紧贴漏斗的瓷板上
D. 抽滤完毕,先断开水泵与吸滤瓶间的橡皮管,然后关闭水龙头
(4)洗涤KMnO4晶体最好的试剂是______。
A. 无水乙醇 B. 乙醇水溶液 C. 氢氧化钾溶液 D. 冷水
(5)晶体干燥时,温度控制在80℃为宜,温度不宜过高的理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能含有![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 中的一种或几种,将该混合物进行如下实验:
中的一种或几种,将该混合物进行如下实验:
①将少许混合物放入水中得到无色溶液和白色沉淀,过滤;
②取溶液进行焰色反应,火焰呈黄色;
③取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体
由上述现象推断:
(1)该混合物中一定含有________,一定不含有________,可能含有________。
(2)若要检验可能含有的物质是否存在,可以采用的实验操作为_____(填写字母)。
A.取步骤①中滤液,加入![]() 溶液
溶液
B.取步骤①中滤液,加入NaOH溶液
C.取步骤①中滤液,加入足量![]() 溶液,静置后在上层清液中加入硝酸酸化
溶液,静置后在上层清液中加入硝酸酸化![]() 溶液
溶液
D.取步骤①中滤液,加入足量![]() 溶液,静置后上层清液中加入硝酸酸化
溶液,静置后上层清液中加入硝酸酸化![]() 溶液
溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com