
【题目】将一定量纯净碳酸氢铵![]() 置于特制恒容的真空容器中(固体试剂体积忽略不计),一定温度下使其达到分解平衡:
置于特制恒容的真空容器中(固体试剂体积忽略不计),一定温度下使其达到分解平衡:![]() 。
。
下列能够说明该分解反应已经达到化学平衡的是( )
A.密闭容器中混合气体的平均摩尔质量不变
B.密闭容器中![]() 体积分数不变
体积分数不变
C.密闭容器中固体的质量不再发生变化
D.三种气体的生成速率之比为1:1:1
【答案】C
【解析】
A. 因为将一定量纯净碳酸氢铵(![]() )固体置于密闭容器中,由于生成的三种气体的物质的量之比始终为1:1:1,所以混合气体的平均摩尔质量一直不变,所以平均摩尔质量不变不能说明反应达到了平衡状态,故A错误;
)固体置于密闭容器中,由于生成的三种气体的物质的量之比始终为1:1:1,所以混合气体的平均摩尔质量一直不变,所以平均摩尔质量不变不能说明反应达到了平衡状态,故A错误;
B. 由于反应物为固体,生成物为气体,生成的三种气体的物质的量之比始终为1:1:1,所以![]() 的体积分数一直不变,所以
的体积分数一直不变,所以![]() 的体积分数不变不能说明反应达到了平衡状态,故B错误;
的体积分数不变不能说明反应达到了平衡状态,故B错误;
C. 密闭容器中固体的质量不再发生变化,就是反应物的质量不再变化,说明各物质的量不变,反应达平衡状态,故C正确;
D. 同一个反应中,速率之比等于计量数之比,只要反应发生就有三种气体的生成速率之比为1:1:1,故D错误。
答案选C。


科目:高中化学 来源: 题型:
【题目】高锰酸钾(KMnO4)是常用的氧化剂。以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体的操作流程如下:
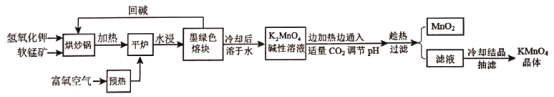
相关资料:①物质溶解度

②锰酸钾[K2MnO4]
外观性状:墨绿色结晶。其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色。
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性中,MnO42-会发生岐化反应。
试回答下列问题:
(1)烘炒前,混配KOH和软锰矿固体,将软锰矿粉碎,其作用是_____,上述流程中趁热过滤的目的是___。
(2)请写出实验中通入适量CO2时体系中可能发生反应的离子方程式:____。
(3)下列有关上述流程及操作说法正确的是_____。
A. 平炉中发生的反应中MnO2的作用是氧化剂
B. 流程中CO2用醋酸溶液代替,得到的产品纯度更高,而不能用盐酸和硫酸代替
C. 抽滤前,应先将滤纸放入布氏漏斗中,微开水龙头,使滤纸紧贴漏斗的瓷板上
D. 抽滤完毕,先断开水泵与吸滤瓶间的橡皮管,然后关闭水龙头
(4)洗涤KMnO4晶体最好的试剂是______。
A. 无水乙醇 B. 乙醇水溶液 C. 氢氧化钾溶液 D. 冷水
(5)晶体干燥时,温度控制在80℃为宜,温度不宜过高的理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能含有![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 中的一种或几种,将该混合物进行如下实验:
中的一种或几种,将该混合物进行如下实验:
①将少许混合物放入水中得到无色溶液和白色沉淀,过滤;
②取溶液进行焰色反应,火焰呈黄色;
③取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体
由上述现象推断:
(1)该混合物中一定含有________,一定不含有________,可能含有________。
(2)若要检验可能含有的物质是否存在,可以采用的实验操作为_____(填写字母)。
A.取步骤①中滤液,加入![]() 溶液
溶液
B.取步骤①中滤液,加入NaOH溶液
C.取步骤①中滤液,加入足量![]() 溶液,静置后在上层清液中加入硝酸酸化
溶液,静置后在上层清液中加入硝酸酸化![]() 溶液
溶液
D.取步骤①中滤液,加入足量![]() 溶液,静置后上层清液中加入硝酸酸化
溶液,静置后上层清液中加入硝酸酸化![]() 溶液
溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关,对下列现象或事实的解释不正确的是( )
选项 | 现象或事实 | 解释或对应的离子方程式 |
A | 用热的纯碱溶液洗去油污 | CO32-+H2O 溶液呈碱性,温度升高碱性增强 |
B | 酸雨样品在空气中放置pH减小 | SO2+H2O=H2SO3 |
C | 用泡沫灭火器灭火 | Al3++3HCO3-=Al(OH)3↓+3CO2↑ |
D | 用加热法除去NaCl固体中混有的NH4Cl固体 | NH4Cl固体在加热条件下可以完全分解成为气体而除去 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和W在周期表中的位置如图所示,已知Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
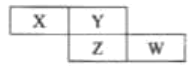
A.X、Y、Z和W均可以与氢元素形成18电子的共价化合物
B.简单离子半径:W<Z<Y<X
C.氧化物对应水化物的酸性:W>Z
D.Y与Z均为非金属,两者不能形成化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固态或气态碘分别与氢气反应的热化学方程式如下:
①![]()
![]()
②![]()
![]()
下列判断不正确的是( )
A.①中的![]() 为固态,②中的
为固态,②中的![]() 为气态
为气态
B.①的反应物总能量比②的反应物总能量高
C.反应①的产物与反应②的产物热稳定性相同
D.1mol 固态碘完全升华会吸热35.96kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示在20mL![]() 溶液中逐滴加入
溶液中逐滴加入![]() 的NaOH溶液的pH变化曲线,下列说法不正确的是( )
的NaOH溶液的pH变化曲线,下列说法不正确的是( )

A.A点溶液存在的关系:![]()
B.C点溶液中各微粒浓度的大小关系为:![]()
C.在D点溶液中:![]()
D.当滴到20mL![]() 溶液时,反应达到终点,滴定过程中此时水的电离程度最大
溶液时,反应达到终点,滴定过程中此时水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +5,-3 | +4,-4 | +1 |
(1)Y在元素周期表中的位置是___。
(2)元素Q和R形成的化合物A是果实催熟剂,用A制备乙醇的化学方程式是___。
(3)单质铜和元素M的最高价氧化物对应水化物的稀溶液发生反应的离子方程式为___。
(4)元素X的金属性比元素Y___(填“强”或“弱”),用原子结构的知识解释原因___。
(5)元素Q、元素Z的含量影响钢铁性能,采用如图装置A在高温下将钢样中元素Q、元素Z转化为QO2、ZO2。
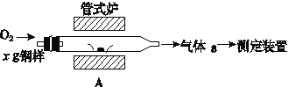
①气体a的成分是__(填化学式)。
②若钢样中元素Z以FeZ的形式存在,在A中反应生成ZO2和稳定的黑色氧化物,则反应的化学方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[ KAl(SO4)2·12H2O ]在造纸、净水等方面应用广泛。以处理过的废旧易拉罐碎屑为原料(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。

回答下列问题:
(1)原料溶解过程中反应的离子方程式是_________________________。
(2)Al(OH)3 与稀硫酸反应的离子方程式是__________________________。
(3)溶液A中通入过量CO2,反应的离子方程式是_________________。
(4)为证明固体B中含有铁,某同学做如下实验:取少量固体B,加入稀硫酸使其溶解,观察到有无色气体生成。向溶液中加入___________,溶液立即变红,证明固体B中含有铁。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com