
【题目】如图表示在20mL![]() 溶液中逐滴加入
溶液中逐滴加入![]() 的NaOH溶液的pH变化曲线,下列说法不正确的是( )
的NaOH溶液的pH变化曲线,下列说法不正确的是( )

A.A点溶液存在的关系:![]()
B.C点溶液中各微粒浓度的大小关系为:![]()
C.在D点溶液中:![]()
D.当滴到20mL![]() 溶液时,反应达到终点,滴定过程中此时水的电离程度最大
溶液时,反应达到终点,滴定过程中此时水的电离程度最大
【答案】B
【解析】
A.A点溶液存在的电荷守恒式为,c(H+)=c(CH3COO-)+c(OH-),则![]() ,故A正确;
,故A正确;
B.C点溶液中含有等物质的量的醋酸和醋酸钠,溶液显酸性,说明醋酸的电离大于醋酸根离子的水解,各微粒浓度的大小关系为:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-),故B错误;
C.D点溶液为滴加15mL0.1mol/L的NaOH,此时溶液中CH3COOH和CH3COONa的浓度之比为1:3,CH3COOH的电离和CH3COO-的水解程度均弱,则D点溶液中:![]() ,故B正确;
,故B正确;
D.当滴到20mL![]() 溶液时,反应达到终点,全部生成CH3COONa,溶液中只在CH3COO-的水解,则滴定过程中此时水的电离程度最大,故D最大;
溶液时,反应达到终点,全部生成CH3COONa,溶液中只在CH3COO-的水解,则滴定过程中此时水的电离程度最大,故D最大;
故答案为B。


科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.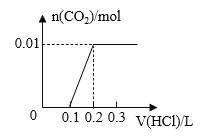 B.
B.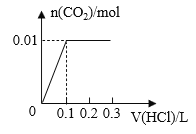
C.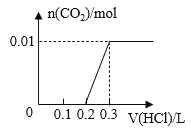 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E是生活中最坚硬的金属。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E是生活中最坚硬的金属。回答下列问题:
(1)用元素符号表示D所在周期(除稀有气体元素外)电负性最大的元素是__;
(2)D的氢化物比C的氢化物的沸点__(填"高"或"低"),原因__;
(3)写出E元素的电子排布式__,已知元素周期表可按电子排布分为s区、p区等,则E元素在__区;
(4)A、B、C最高价氧化物的晶体类型是分别是___晶体,__晶体,__晶体;
(5)画出D的核外电子排布图___,这样排布遵循了__原理和___规则。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净碳酸氢铵![]() 置于特制恒容的真空容器中(固体试剂体积忽略不计),一定温度下使其达到分解平衡:
置于特制恒容的真空容器中(固体试剂体积忽略不计),一定温度下使其达到分解平衡:![]() 。
。
下列能够说明该分解反应已经达到化学平衡的是( )
A.密闭容器中混合气体的平均摩尔质量不变
B.密闭容器中![]() 体积分数不变
体积分数不变
C.密闭容器中固体的质量不再发生变化
D.三种气体的生成速率之比为1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示示意图,下列说法不正确的是( )
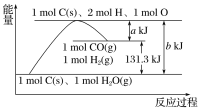
A.反应C(s)+H2O(g)=CO(g)+H2(g),能量增加(b-a)kJ·mol-1
B.该反应过程反应物断键吸收的能量大于生成物成键放出的能量
C.1molC(s)和1molH2O(l)反应生成1molCO(g)和1molH2(g)吸收的热量为131.3kJ
D.1molC(s)、2molH、1molO转变成1molCO(g)和1molH2(g)放出的热量为akJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,CaCO3在水中的溶解平衡曲线如图所示。已知25 ℃时,CaCO3的Ksp(CaCO3)=2.8×10-9。据图分析,下列说法不正确的是( )
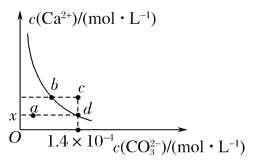
A. x的数值为2×10-5
B. c点时有碳酸钙沉淀生成
C. b点与d点对应的溶度积相等
D. 加入蒸馏水可使溶液由d点变到a点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要有机化工原料。结合以下路线回答:
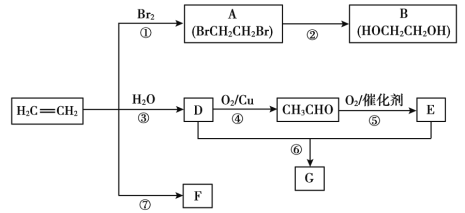
已知:2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
(1)反应①的化学方程式是__。
(2)B的官能团是__。
(3)F是一种高分子,可用于制作食品袋,其结构简式为__。
(4)G是一种油状、有香味的物质,有以下两种制法。
制法一:实验室用D和E反应制取G,某学习小组在实验室制取乙酸乙酯的主要步骤如下:
i.配制2mL浓硫酸、3mLD(含18O)和2mLE的混合溶液。
ii.按如图连接好装置并加入混合液,用小火均匀加热3~5min。
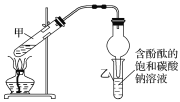
iii.待试管乙收集到一定量产物后停止加热,撤出试管乙用力振荡,然后静置待分层。
iv.分离出乙酸乙酯,洗涤、干燥。
回答问题:
①装置中球形干燥管,除起冷凝作用外,另一重要作用是___。
②步骤②安装好实验装置,加入药品前还应检查__。
③反应中浓硫酸的作用是__;写出能表示18O位置的制取乙酸乙酯的化学方程式:__。
④上述实验中饱和碳酸钠溶液的作用是__(填字母)。
a.中和乙酸并吸收乙醇
b.中和乙酸和乙醇
c.降低乙酸乙酯的溶解度
d.加速酯的生成,提高其产率
⑤步骤③所观察到的现象是__;从试管乙中分离出乙酸乙酯的实验操作名称是___。
制法二:工业上用CH2=CH2和E直接反应获得G。
a.反应类型是__。
b.与制法一相比,制法二的优点是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于净化汽车尾气的反应:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g),已知该反应速率极慢,570K时平衡常数为1×1059。下列说法正确的是
2CO2(g)+N2(g),已知该反应速率极慢,570K时平衡常数为1×1059。下列说法正确的是
A.装有尾气净化装置的汽车排出的气体中一定不再含有NO或CO
B.提高尾气净化效率的常用方法是升高温度
C.提高尾气净化效率的最佳途径是研制高效催化剂
D.570K时该反应正向进行的程度很大,故使用催化剂并无实际意义
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.同温同压条件下,等质量的氧气和臭氧体积比为2∶3
B.33.6 L NH3气体所含分子的物质的量为1.5 mol
C.常温常压下,22 g CO2所含有的分子数为0.5NA
D.标准状况下,11.2 L水中含有的分子数为0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com