
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E是生活中最坚硬的金属。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E是生活中最坚硬的金属。回答下列问题:
(1)用元素符号表示D所在周期(除稀有气体元素外)电负性最大的元素是__;
(2)D的氢化物比C的氢化物的沸点__(填"高"或"低"),原因__;
(3)写出E元素的电子排布式__,已知元素周期表可按电子排布分为s区、p区等,则E元素在__区;
(4)A、B、C最高价氧化物的晶体类型是分别是___晶体,__晶体,__晶体;
(5)画出D的核外电子排布图___,这样排布遵循了__原理和___规则。
【答案】F 高 NH3分子间形成氢键 1s22s22p63s23p63d54s1 d 原子 离子 分子 ![]() 泡利 洪特
泡利 洪特
【解析】
A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:![]() ,则A为Si,B是同周期第一电离能最小的元素,则B为Na,C的最外层有三个成单电子,故C为P,D为N,E是生活中最坚硬的金属,则E为Cr。
,则A为Si,B是同周期第一电离能最小的元素,则B为Na,C的最外层有三个成单电子,故C为P,D为N,E是生活中最坚硬的金属,则E为Cr。
⑴N是第二周期,因此所在周期(除稀有气体元素外)电负性最大的元素是F;故答案为:F。
⑵D的氢化物NH3比C的氢化物PH3的沸点高,原因氨气分子间形成氢键;故答案为:高;NH3分子间形成氢键。
⑶E为Cr是24号元素,其电子排布式1s22s22p63s23p63d54s1,因此Cr在d区;故答案为:1s22s22p63s23p63d54s1;d。
⑷A、B、C最高价氧化物分别是SiO2、Na2O、P2O5,因此其晶体类型是分别是原子晶体,离子晶体,分子晶体;故答案为:原子;离子;分子。
⑸N的核外电子排布图![]() ,这样排布遵循了泡利原理和洪特规则;故答案为:
,这样排布遵循了泡利原理和洪特规则;故答案为:![]() ;泡利;洪特。
;泡利;洪特。


科目:高中化学 来源: 题型:
【题目】常温下,氯水中部分含氯微粒的物质的量浓度随pH的变化趋势如图所示。下列叙述正确的是
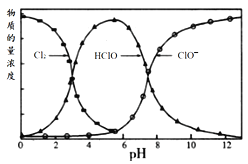
A.pH=1的新制氯水中,c(Cl2)>c(HClO)>c(ClO-)
B.随着pH增大,溶液的颜色加深
C.当pH=10时,溶液中的含氯微粒只有ClO-
D.向pH=4的氯水中加入NaOH溶液,只发生化学反应:HClO+NaOH=NaClO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.标准状况下,22.4 L水中所含的分子数约为6.02×1023个
B.1 mol Cl2中含有的原子数为NA
C.标准状况下,aL氧气和氮气的混合物含有的分子数约为![]() ×6.02×1023个
×6.02×1023个
D.常温常压下,11.2 L CO分子数是0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能含有![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 中的一种或几种,将该混合物进行如下实验:
中的一种或几种,将该混合物进行如下实验:
①将少许混合物放入水中得到无色溶液和白色沉淀,过滤;
②取溶液进行焰色反应,火焰呈黄色;
③取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体
由上述现象推断:
(1)该混合物中一定含有________,一定不含有________,可能含有________。
(2)若要检验可能含有的物质是否存在,可以采用的实验操作为_____(填写字母)。
A.取步骤①中滤液,加入![]() 溶液
溶液
B.取步骤①中滤液,加入NaOH溶液
C.取步骤①中滤液,加入足量![]() 溶液,静置后在上层清液中加入硝酸酸化
溶液,静置后在上层清液中加入硝酸酸化![]() 溶液
溶液
D.取步骤①中滤液,加入足量![]() 溶液,静置后上层清液中加入硝酸酸化
溶液,静置后上层清液中加入硝酸酸化![]() 溶液
溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯、乙醛为原料,AlCl3 为催化剂制备 1,1–二苯乙烷,其反应原理为:
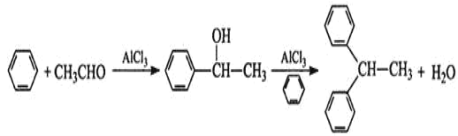
已知:AlCl3 固体遇水会发生较强烈水解。 I.制取装置如图所示。
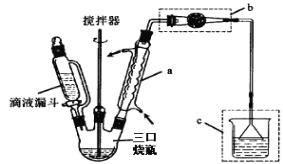
(1)该反应需控制反应温度为 20℃。控制 20℃的方法是________ ;该反应不高于 20℃ 的可能原因是:_______ 。
(2)仪器 a 的名称是 __________ 作用是 _________ ;装置 c 的作用是吸 收 HCl,写出产生 HCl 的化学方程式 ________;装置 b 的作用是 _____________ 。
Ⅱ.实验结束后,将三口烧瓶中的混合物倒入冷稀盐酸中,用分液漏斗分离出有机层,依 次用水、2%碳酸钠溶液、水洗涤,洗涤后加入少量无水硫酸镁固体,过滤、蒸馏,得到 1, 1–二苯乙烷。
(3)分液漏斗中,产品在____(填“上”或“下”)层;洗涤操作中,第二次水洗的目的 是____;无水硫酸镁也可用物质 ______________ 代替。
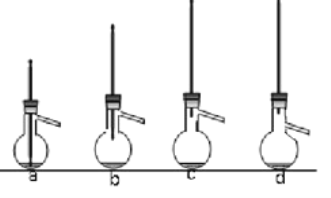
(4)蒸馏提纯时,下列装置中会导致收集到的产品中混有低沸点杂质的装置是______ (选填编号)。
(5)三口烧瓶中加入 120mL 苯(密度 0.88g/mL)、19g A1C13 和 3.7g 乙醛,20℃时充分反应, 制得纯净的 1,1–二苯乙烷 7.8g。该实验的产率约为 ___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、生活密切相关,对下列现象或事实的解释不正确的是( )
选项 | 现象或事实 | 解释或对应的离子方程式 |
A | 用热的纯碱溶液洗去油污 | CO32-+H2O 溶液呈碱性,温度升高碱性增强 |
B | 酸雨样品在空气中放置pH减小 | SO2+H2O=H2SO3 |
C | 用泡沫灭火器灭火 | Al3++3HCO3-=Al(OH)3↓+3CO2↑ |
D | 用加热法除去NaCl固体中混有的NH4Cl固体 | NH4Cl固体在加热条件下可以完全分解成为气体而除去 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和W在周期表中的位置如图所示,已知Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
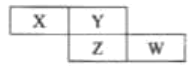
A.X、Y、Z和W均可以与氢元素形成18电子的共价化合物
B.简单离子半径:W<Z<Y<X
C.氧化物对应水化物的酸性:W>Z
D.Y与Z均为非金属,两者不能形成化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示在20mL![]() 溶液中逐滴加入
溶液中逐滴加入![]() 的NaOH溶液的pH变化曲线,下列说法不正确的是( )
的NaOH溶液的pH变化曲线,下列说法不正确的是( )

A.A点溶液存在的关系:![]()
B.C点溶液中各微粒浓度的大小关系为:![]()
C.在D点溶液中:![]()
D.当滴到20mL![]() 溶液时,反应达到终点,滴定过程中此时水的电离程度最大
溶液时,反应达到终点,滴定过程中此时水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种。
(1)请用上述物质填空(不用配平):C+________+H2SO4——________+______+Cr2(SO4)3+H2O。
(2)上述反应中氧化剂是(填化学式)________,被氧化的元素是(填元素符号)________。
(3)H2SO4在上述反应中表现出来的性质是(填选项序号)________。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com