
【题目】下列各组粒子,属于同种核素的是_____(填编号,下同),互为同位素的是______,互为同素异形体的是_____,属于同种物质的是_________。
①16O2和18O3②16O2和18O2③ H、D、T ④![]() 和
和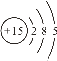 (核内15个中子)
(核内15个中子)
【答案】④ ③ ① ②
【解析】
核素是指具有一定数目质子和一定数目中子的原子,同种核素即质子数、中子数分别相同的核素;具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素;同素异形体是同种元素形成的不同单质;分子式相同、结构也相同的物质属于同种物质。
①16O2和18O3 是同种元素形成的不同单质,互为同素异形体;
②16O2和18O2是同种元素形成的同种单质,属于同种物质;
③H、D、T的质子数都为1,中子数分别为0、1、2,属于质子数相同、中子数不同的氢元素的不同核素,互为同位素;
④![]() 和
和  (核内15个中子)的质子数都为15,中子数都为15,是两种质子数、中子数分别相同的核素,属于同种核素;
(核内15个中子)的质子数都为15,中子数都为15,是两种质子数、中子数分别相同的核素,属于同种核素;
综上,属于同种核素的是④,互为同位素的是③,互为同素异形体的是①,属于同种物质的是②,答案为:④;③;①;②。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁过氧化氢燃料电池系统。其工作原理如图所示。以下说法中错误的是( )

A.电池的负极反应为:Mg-2e-===Mg2+
B.电池工作时,H+向负极移动
C.电池工作一段时间后,溶液的pH增大
D.电池总反应式是:Mg+H2O2+2H+===Mg2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下:Ksp(AgCl)=1.6×10-10,下列叙述正确的是 ( )
A.AgCl在饱和NaCl溶液中的Ksp比在纯水中的小
B.AgCl的悬浊液中c(Cl-)=4×10-5.5mol/L
C.将0.001 mol·L-1AgNO3溶液滴入0.001 mol·L-1的KCl,无沉淀析出
D.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为Kw,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A.a=b
B.混合溶液中,c(H+)=![]() mol·L-1
mol·L-1
C.混合溶液的pH=7
D.混合溶液中,c(H+)+ c(B+)= c(OH-)+ c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题。雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成。
(1)机动车的尾气是雾霾形成的原因之一,近几年有人提出利用选择性催化剂让汽油中挥发出来的C3H6催化还原尾气中的NO气体,请写出该过程的化学方程式:__________
(2)到了冬季,我国北方烧煤供暖所产生的废气也是雾霾的主要来源之一。经研究发现将煤炭在O2/CO2的气氛下燃烧,发现能够降低燃煤时NO的排放,主要反应为:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH
N2(g)+2CO2(g) ΔH
若① N2(g)+O2(g)![]() 2NO(g) ΔH1= +180.5 kJmol-1
2NO(g) ΔH1= +180.5 kJmol-1
② CO(g)![]() C(s)+1/2O2(g) ΔH2= +110.5 kJmol-1
C(s)+1/2O2(g) ΔH2= +110.5 kJmol-1
③ C (s)+O2(g)![]() CO2(g) ΔH3= -393.5 kJmol-1
CO2(g) ΔH3= -393.5 kJmol-1
则ΔH=_____________kJmol-1。
(3)燃煤尾气中的SO2用NaOH溶液吸收形成NaHSO3溶液,在pH为4~7之间时电解,硫元素在铅阴极上被电解还原为Na2S2O4。Na2S2O4俗称保险粉,广泛应用于染料、印染、造纸、食品工业以及医学上。这种技术是最初的电化学脱硫技术之一。请写出该电解反应中阴极的电极方程式:______________________________________。
(4)SO2经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g) +O2(g)![]() 2SO3(g)。若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
2SO3(g)。若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
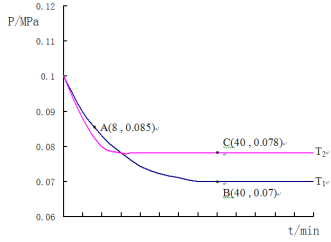
①该反应的化学平衡常数表达式:K=__________________。
②图中A点时,SO2的转化率为________________
③计算SO2催化氧化反应在图中B点的压强平衡常数K=_______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
④若在T2℃,其他条件不变的情况下测得压强的变化曲线如图所示,则T1____T2(填“>”、“<”、“=”);其中C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正) ____vA(逆) (填“>”、“<”、“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.18gH2O中含有的中子数为10NA
B.同一元素的核素种类数由中子数决定
C.质子数相同的微粒一定属于同一种元素
D.通过化学变化可以实现![]() 与
与![]() 之间的相互转化
之间的相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如图:
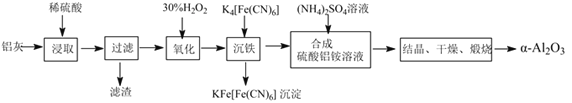
(1)铝灰中氧化铝与硫酸反应的化学方程式为___。
(2)图中“滤渣”的主要成分为___(填化学式)。加30%的H2O2溶液发生的离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。
(3)验证“沉铁”后,溶液中是否还含有铁离子的操作方法为___。
(4)煅烧硫酸铝铵晶体,发生的主要反应为4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O。将产生的气体通过如图所示的装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O。将产生的气体通过如图所示的装置。

①集气瓶中收集到的气体是___(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有__(填化学式)。
③KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示,主要步骤如下:

步骤1:三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴。
步骤2:缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3:反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤,得到三乙醚合溴化镁粗品。
步骤4:常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤,得到三乙醚合溴化镁,加热至160℃分解得到无水MgBr2产品。
已知:
①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5。
MgBr2·3C2H5OC2H5。
回答下列问题:
(1)装置中无水氯化钙的作用是___。实验中不能用干燥的空气代替干燥的N2,原因是___。
(2)如将装置B改为装置C,可能会导致的后果是___。
(3)装置中使用球形冷凝管的目的是___。
(4)步骤4中用苯溶解粗品,除去产品中的___杂质。
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式为Mg2++Y4-=MgY2-。
①滴定前润洗滴定管的操作方法是___。
②测定前,选称取0.2500g无水MgBr2产品,溶解后,用0.0500mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是___(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用如图装置模拟在A池中实现铁上镀铜,在C装置中实现工业KCl制取KOH溶液。
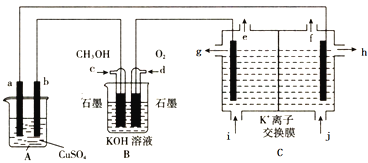
下列有关说法错误的是
A. a为精铜,b为铁制品可实现镀铜要求
B. c为负极,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O
C. 从e出来的气体为氧气,从f出来的气体为氢气
D. 钾离子从电解槽左室向右室迁移,h口出来的为高浓度的KOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com