
【题目】下列各组物质中,由极性键构成的极性分子是( )
A. CH4 B. NH3 C. C2H2 D. CO2
科目:高中化学 来源: 题型:
【题目】下列实验中,所加固体可以完全溶解的是( )
A. 在H2O2溶液中加入少量MnO2粉末
B. 将一小块铝片投入足量NaOH溶液中
C. 将少量氢氧化铝加入足量的浓氨水中
D. 常温下将一小块铁片投入足量浓硝酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
合成氨的反应中的能量变化如图所示。
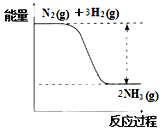
①该反应是___________反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量_____(填“大于”或“小于”)生成物化学键形成放出的总能量。
②在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述不能说明该反应达到平衡状态的是___________(填序号)。
A.容器中混合气体的密度不随时间变化
B.单位时间内断裂3 mol H-H键的同时断裂6 mol N-H键
C.N2 、H2 、NH3的物质的量之比为1:3:2
D.容器中混合气体的平均相对分子质量不随时间变化
③一种用于驱动潜艇的液氨-液氧燃料电池原理示意如图:
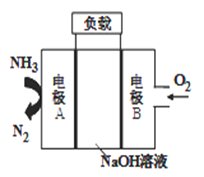
电极A上发生的电极反应为:_____________________。
若电池工作一段时间后,消耗标准状况下的氧气11.2L,则该过程转移电子______mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的有机合成基础原料。以下是由乙烯合成高分子化合物PVB、缩醛M、碳酸二甲酯等重要有机物的合成路线。
 已知:醛与二元醇可生成环状缩醛:
已知:醛与二元醇可生成环状缩醛:![]()
请回答下列问题:
(1)B的名称是______________, C的名称是__________。
(2)反应③的反应类型是_____________,缩醛M的分子式是_____________。
(3)反应④的化学方程式是___________。
(4)D的结构简式是 ___________。
(5)缩醛M有多种同分异构体,其中属于羧酸,且苯环上只有两个取代基的同分异构体共有_______种。
(6)参照的合成路线,设计一条由2-溴丙烷制备 的合成路线(注明必要的反应条件):
的合成路线(注明必要的反应条件):
_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化亚铜(CuBr)常用作有机合成原料和反应催化剂等,它是一种不溶于水的白色结晶粉末,受热或见光易分解,接触空气会被缓慢氧化成绿色粉末。制备CuBr的实验步骤如下:
步骤1:在如图所示的三颈烧瓶中加入45gCuSO4·5H2O、19gNaBr、150mL煮沸过的蒸馏水,60℃时不断搅拌,以适当流速通入SO22小时。
步骤2:溶液冷却后倾去上层清液,在避光的条件下过滤。
步骤3:依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤。
步骤4:将获得的产品经系列干燥剂干燥后,再进行真空干燥。

请根据上述制备步骤回答有关问题:
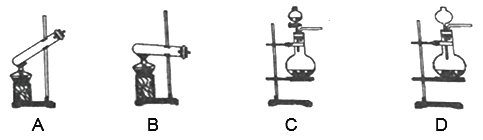
(1)制备中用到的SO2在实验室中通常是用浓硫酸和亚硫酸钠为原料来制备的,在制备SO2时装置可以选择下图中的____________(填装置编号),发生反应的化学方程式为____________。
(2)步骤1中:①所用蒸馏水需提前煮沸处理,这样做的目的是____________。
②为控制反应在60℃进行可采取的措施是________________。
③三颈烧瓶中反应生成CuBr的离子方程式为_____________。
④判断反应已经完成的现象是______________。
(3)步骤2在过滤时需要避光的原因是___________。
(4)步骤3中用到的洗涤剂水、乙醇中均“溶有少量SO2”的原因是____________。
(5)欲利用上述装置烧杯中的吸收液(经检测主要含Na2SO3、NaHSO3等)制取较纯净的Na2SO3·7H2O晶体。需用到以下试剂:SO2(贮存在钢瓶中)、100g20%NaOH溶液、乙醇等。请将下列实验步骤补充完整。
①向烧杯中继续通入SO2至溶液饱和;②____________;③加入少量维生素C溶液(抗氧化剂),蒸发浓缩,冷却结晶;④______________;⑤放真空干燥箱中干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学平衡移动的分析中,不正确的是( )
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定增大
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定增大
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A. ①④ B. ①②③
C. ②③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lg(Ag+),Ksp(AgCl)=1×10-12。如图是向10mLAgNO3溶液中逐渐加入0.1mol![]() L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。根据图像所得下列结论正确的是[提示:Ksp(AgCl) >Ksp(AgI)]
L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。根据图像所得下列结论正确的是[提示:Ksp(AgCl) >Ksp(AgI)]

A.相同温度下,AgCl在纯水和在NaCl溶液中的溶解度相等
B.原AgNO3溶液的物质的量浓度为0.1mol![]() L-1
L-1
C.图中x点的坐标为(100,6)
D.把0.1mol![]() L-1的NaCl溶液换成0.1mol
L-1的NaCl溶液换成0.1mol![]() L-1的NaI溶液则图像变为虚线部分
L-1的NaI溶液则图像变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 42gC3H6中含有的共用电子对数目为8NA
B. 由6gCaCO3和5gKHCO3组成的混合物中含有的碳原子数为0.11NA
C. 标准状况下,22.4L氯气和56g铁充分反应,转移的电子数为3NA
D. 1L0.01mol·L-1Kal(SO4)2溶液中含有的阳离子数为0.02NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com