
| | A | B | C | D |
| 强电解质 | HCl | FeCl3 | H3PO4 | HClO |
| 弱电解质 | HF | CH3COOH | BaSO4 | Ba(OH)2 |
| 非电解质 | NH3 | Cu | H2O | C2H5OH |


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源:不详 题型:单选题
A.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)= c(HCO )+c(H2CO3) )+c(H2CO3) |
| B.pH=4.5的柠檬汁中c(H+)是pH=6.5的番茄汁中c(H+)的100倍 |
| C.100 ml pH=3的HA溶液、HB溶液分别与足量的锌反应,HA溶液放出的氢气较多,说明HA的酸性比HB的强 |
| D.pH=5.5的CH3COOH与CH3COONa混合溶液中:c(Na+)> c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.18mol·L-1的醋酸加水稀释,c(H+)/c(OH-)减小 |
| B.体积相同、pH相同的醋酸和盐酸完全溶解等量的镁粉,后者用时少 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大(不考虑温度变化) |
| D.V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向AgCl悬浊液中加入少量NaCl固体后振荡,c(Cl-)增大,KsP (AgCl)增大 |
B.某溶液中由水电离出的 时,则该溶液的pH一定为14-a 时,则该溶液的pH一定为14-a |
| C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后溶液的pH等于7,则混合溶液 中: 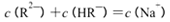 |
D.相同物质的量浓度的 溶液中,c (NH4+)由大到小的顺序是:①>②>③>④ 溶液中,c (NH4+)由大到小的顺序是:①>②>③>④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 序号 | ① | ② | ③ | ④ |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 8.8 | 9.7 | 11.6 | 10.3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.由水电离出的c(H+):①=②=③=④ |
| B.将②、③溶液混合后,pH=7,消耗溶液的体积:③>② |
| C.等体积的①、②、④溶液分别与足量铝粉反应,②生成的H2的物质的量最大 |
| D.向溶液中加入100mL水后,溶液的pH:③>④>①>② |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入适量的物质是:①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥加入少量MgSO4固体
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入适量的物质是:①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥加入少量MgSO4固体| A.①②③⑤ | B.③⑥ | C.③ | D.③⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度(mol·L-1) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液中所有离子的浓度都减小 |
| B.CH3COOH的电离程度变大 |
| C.水的电离程度变大 |
| D.溶液的pH增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com