
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度(mol·L-1) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.通入二氧化碳气体 | B.加入氢氧化钠固体 |
| C.通入氯化氢气体 | D.加入饱和石灰水溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | A | B | C | D |
| 强电解质 | HCl | FeCl3 | H3PO4 | HClO |
| 弱电解质 | HF | CH3COOH | BaSO4 | Ba(OH)2 |
| 非电解质 | NH3 | Cu | H2O | C2H5OH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HClO是弱酸,所以NaClO是弱电解质 |
| B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D.电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(H+) | B.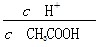 |
| C.c(H+)·c(OH-) | D.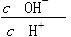 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液的pH增大 | B.CH3COOH电离的百分率变大 |
| C.溶液的导电能力减弱 | D.溶液中c(OH-)减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com