
| A. | 甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ | |
| B. | 含大量Al3+的溶液中:K+、Na+、NO3-、HCO3- | |
| C. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液中:CO32-、Cl-、F-、K+ | |
| D. | 由水电离出的c(OH-)=1×10-13 mol•L-1的无色溶液中:NO3-、Ba2+、K+、Cl- |
分析 A.甲基橙呈黄色的溶液,pH>4.4;
B.与Al3+反应的离子不能大量共存;
C.常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液呈碱性;
D.由水电离出的c(OH-)=1×10-13 mol•L-1的无色溶液,可能呈酸性或碱性.
解答 解:A.甲基橙呈黄色的溶液,pH>4.4,碱性条件下离子之间不发生任何反应,可大量共存,故A正确;
B.HCO3-与Al3+发生互促水解反应而不能大量共存,故B错误;
C.常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液呈碱性,碱性条件下离子之间不发生任何反应,可大量共存,故C正确;
D.由水电离出的c(OH-)=1×10-13 mol•L-1的无色溶液,可能呈酸性或碱性,无论呈酸性还是碱性,离子之间不发生任何反应,可大量共存,故D正确.
故选B.
点评 本题考查离子的共存,为高频考点,侧重学生的分析能力的考查,把握常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,注意常见物质的溶解性,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
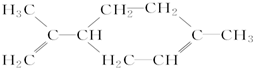
| A. | 柠檬烯的分子式为C10H16,能使溴的四氯化碳溶液褪色 | |
| B. | 柠檬烯分子为非极性分子 | |
| C. | 柠檬烯分子中所有碳原子处于同一个平面上 | |
| D. | 柠檬烯能与酸性高锰酸钾溶液发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 L氨气体分解成1 L氮气与3 L氢气吸收92 kJ热量 | |
| B. | 1 mol氮气与3 mol氢气反应生成2 mol液态氨放出的热量小于92 kJ | |
| C. | 25℃和101kPa时,2 molNH3(g)完全分解为1 mol N2(g)和3 mol H2(g )吸热92KJ | |
| D. | 3个氢气分子与1个氮气分子反应生成2个氨气分子放出92 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



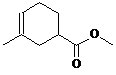 、
、 .
.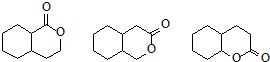 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com