
图中X、Y、Z为单质,其他为化学物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应。
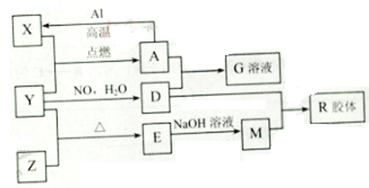
回答下列问题:
(1)组成单质Y的元素在周期表中的位置是 ;M中存在的化学键类型为 ;R的化学式是 。
(2)一定条件下,Z与H2反应生成ZH4,ZH4的电子式为 。
(3)已知A与1molAl反应转化为X时(所有物质均为固体)。放出aKJ热量。写出该反应的热化学方程式:
。
(4)写出A和D的稀溶液反应生成G的离子方程式:
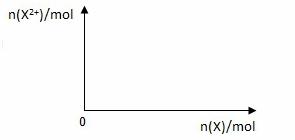
(5)向含4mol D的稀溶液中,逐渐加入X粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。

【解析】本题属于无机框图题,这种类型的试题关键是关键是找准题眼,即突破点。A俗称磁性氧化铁,因此A是Fe3O 4,在高温下Fe3O4与单质Al发生铝热反应,生成单质铁和Al2O3,而铁在点燃时与氧气化合即生成Fe3O4,所以X、Y分别是铁和氧气;在水中氧气与NO反应生成硝酸,所以D是硝酸;硝酸具有强氧化性与Fe3O4反应,生成Fe(NO3)3、NO和水,因此G是Fe(NO3)3;又因为E是不溶于水的酸性氧化物,且能与氢氟酸反应,所以E只能是SiO2,因此Z单质是硅,SiO2与NaOH溶液反应生成M,所以M是Na2SiO3,Na2SiO3与硝酸反应即生成硅酸胶体,所以R是H2SiO3。0
4,在高温下Fe3O4与单质Al发生铝热反应,生成单质铁和Al2O3,而铁在点燃时与氧气化合即生成Fe3O4,所以X、Y分别是铁和氧气;在水中氧气与NO反应生成硝酸,所以D是硝酸;硝酸具有强氧化性与Fe3O4反应,生成Fe(NO3)3、NO和水,因此G是Fe(NO3)3;又因为E是不溶于水的酸性氧化物,且能与氢氟酸反应,所以E只能是SiO2,因此Z单质是硅,SiO2与NaOH溶液反应生成M,所以M是Na2SiO3,Na2SiO3与硝酸反应即生成硅酸胶体,所以R是H2SiO3。0 
Na2SiO3属于离子化合物,一定含有离子键,同时Si和O之间还存在极性键;Si与H2在高温下生成甲硅烷即SiH4,SiH4是由极性键构成的共价化合物,电子式是: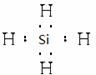 ;向稀硝酸溶液中加入铁粉反应的方程式为Fe+4HNO3=Fe(NO3)3+2H2O+NO↑,当铁粉过量时,铁会继续和Fe(NO3)3反应,生成Fe(NO3)2,方程式为Fe+
;向稀硝酸溶液中加入铁粉反应的方程式为Fe+4HNO3=Fe(NO3)3+2H2O+NO↑,当铁粉过量时,铁会继续和Fe(NO3)3反应,生成Fe(NO3)2,方程式为Fe+ 2Fe(NO3)3=3Fe(NO3)2。由方程式可知4mol硝酸生成1molFe(NO3)3,1molFe(NO3)3生成1molFe(NO3)2,即n(Fe2+)的最大值是1.5mol。
2Fe(NO3)3=3Fe(NO3)2。由方程式可知4mol硝酸生成1molFe(NO3)3,1molFe(NO3)3生成1molFe(NO3)2,即n(Fe2+)的最大值是1.5mol。
【答案】(1)第二周期第ⅥA族 离子键 共价键 H2SiO3(H4SiO4)
(2)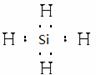
(3)8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s) △H=-8aKJ/mol
(4)3Fe3O4+28H++NO3-=9Fe3++14H2O+NO↑
(5)




科目:高中化学 来源: 题型:
如右图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高

查看答案和解析>>
科目:高中化学 来源: 题型:
小明和小红对市场上销售的一种分袋包装的蛋糕发生了兴趣,因为蛋糕包装在充满气
体的小塑料袋内,袋内的气体充得鼓鼓的,看上去好像一个小“枕头”。他们认为这
种充气包装技术,主要是为了使食品能够较长时间地保鲜、保质。那么,这是什么气
体呢?小红猜想是氮气,小明猜想是二氧化碳。
(1)请你帮助他们设计一个简单的实验方案,判断小明的猜想是否正确,简要写出操
作步骤: _________________________________________________________ _____。
(2)小明的猜想如果正确,现象应是________________________ _________。
(3)你认为食品充气包装对所充气体的要求是: ①_________ _____________;
②________________ ________;③_____ ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A. Fe分别与氯气和稀盐酸反应所得氯化物相同
B.K、Zn分别与不足量的稀硫酸反应所得溶液均呈中性
C. Li、Na、K的原子半价和密度随原子序数的增加而增大
D.C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强

查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )
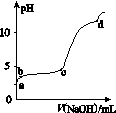
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为Al3++3OH-Al(OH)3
B.a~b段,溶液pH增大,Al3+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:
 | 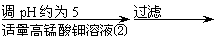 | 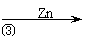 |
工业ZnO 浸出液 滤液
 | |||||
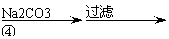 | |||||
 | |||||
滤液 滤饼 ZnO
提示:在本实脸条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2
回答下列问题:
(1)反应②中除掉的杂质离子是 ,发生反应的离子方程式为 ;
加高锰酸钾溶液前,若pH较低,对除杂的影响是 ;
(2)反应③的反应类型为 。过滤得到的滤渣中,除了过量的锌外还有 ;
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是
。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2 .取干操后的滤饼11.2g,煅烧后可得到产品8.1 g. 则x等于 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com