
【题目】下列事实不能用电化学理论解释的是( )
A、轮船水线以下的船壳上镶嵌有一定量的锌块
B、镀锌的铁制品比镀锡的铁制品耐用
C、铝片不用特殊方法保存
D、锌跟稀硫酸反应时,滴入少量硫酸铜溶液后,反应速率加快
科目:高中化学 来源: 题型:
【题目】以NA代表阿伏加德罗常数的值,则关于热化学方程式C2H2(g)+![]() O2(g) →2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )
O2(g) →2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )
A.当10NA个电子转移时,该反应吸收1300 kJ的能量
B.当1NA个水分子生成且为液体时,吸收1300 kJ的能量
C.当2NA个碳氧共用电子对生成时,放出1300 kJ的能量
D.当8NA个碳氧共用电子对生成时,放出1300 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浮选凝聚法处理酸性污水的工作原理如图所示,下列说法不正确的是

A. Fe电极的电极反应式为:Fe-2e-═Fe2+
B. 通入空气的石墨电极的电极反应式为O2+2CO2+4e-═2CO32-
C. 通入甲烷的石墨电极的电极反应式为:CH4+100H--8e-═CO32-+7H2O
D. 为增强污水的导电能力,可向污水中加入适量工业用食盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C的简单离子和B的简单离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物中阴阳离子的个数比为1:1。回答下列问题:
(1)五种元素中,原子半径最大的是____________(填元素名称),非金属性最强元素的是___________。
(2)由元素A分别和元素B、D、E所形成的共价型化合物中,热稳定性最差的是
______________(用化学式表示)。
(3)元素A和E形成的化合物与元素A和B形成的化合物反应,产物的电子式为_________________,其中存在的化学键类型为_________________________。
(4)E离子的结构示意图是____________________;
元素D最高价氧化物的水化物的化学式为_________________。
(5)单质E与水反应的离子方程式为 ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据题目要求回答以下问题:
(1)CuSO4·5H2O的摩尔质量是________; 0.1mol CH4含有的氢原子数为____; 0.2 mol·L-1的 AlCl3溶液中Cl—的物质的量浓度是________。
(2)现有以下物质:①NaCl ②氯水③醋酸 ④HCl ⑤酒精(C2H5OH)⑥CaCO3⑦Ba(OH)2属于强电解质的是__________,属于弱电解质的是_______。(填序号)
写出Ba(OH)2的电离方程式_________________________,
写出④与⑥反应的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程不涉及化学反应的是
A. 含活性炭、细铁、食盐及蛭石等的暖手宝,在被使用时会发热
B. 用活性炭口罩防护空气中的粉尘等有害物质
C. 汽车排气管安装尾气催化转化装置
D. 通过煤的气化获得水煤气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度为 0.1 mol/L、体积为 V L 的氨水中逐滴加入 0.1 mol/L 的盐酸,下列 各选项中数值变大的有
![]()
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习小组进行如下实验。
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化)。限选试剂和仪器:0.20mol/LH2C2O4 溶液、0.010mol/L KMnO4 溶液(酸性)、蒸馏水、 试管、量筒、秒表、恒温水浴槽
(1)上述实验①②是探究 对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a 为 ;乙是实验需要测量的物理量,则表 格中“乙”应填写 。
【测定 H2C2O4·xH2O 中 x 值】 已知:M(H2C2O4)=90g/mol
称取 1.260 g 纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液。
②取 25.00 mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000 mol·L-1 的 KMnO 标准溶液进行滴定;
(2)请写出与滴定有关反应的离子方程式
(3)某学生的滴定方式(夹持部分略去)如下,最合理的是 (选填 a、b)。


(4)由右图可知消耗 KMnO4 溶液体积为 mL;
(5)滴定过程中眼睛应注视_________________;
(6)通过上述数据,求得 x= 。以标准 KMnO4 溶液滴定样品溶液的浓度,未用 标准 KMnO4 溶液润洗滴定管,引起实验结果 (偏大、偏小或没有影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g)![]() xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
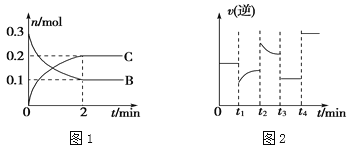
下列有关说法正确的是( )
A. x=2,反应开始2 min内,v(B)=0.1 mol/(L·min)
B. t1时改变的条件是降温,平衡逆向移动
C. t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大
D. t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com