
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C的简单离子和B的简单离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物中阴阳离子的个数比为1:1。回答下列问题:
(1)五种元素中,原子半径最大的是____________(填元素名称),非金属性最强元素的是___________。
(2)由元素A分别和元素B、D、E所形成的共价型化合物中,热稳定性最差的是
______________(用化学式表示)。
(3)元素A和E形成的化合物与元素A和B形成的化合物反应,产物的电子式为_________________,其中存在的化学键类型为_________________________。
(4)E离子的结构示意图是____________________;
元素D最高价氧化物的水化物的化学式为_________________。
(5)单质E与水反应的离子方程式为 ____________________________________。
【答案】 钠 氯 PH3 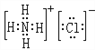 离子键和共价键
离子键和共价键  H3PO4或HPO3 Cl2+ H2O== H++ Cl-+ HClO
H3PO4或HPO3 Cl2+ H2O== H++ Cl-+ HClO
【解析】五种短周期元素A﹑B﹑C﹑D﹑E的原子序数依次增大,A和B形成的化合物在水中呈碱性,则化合物为氨气,则A为H,B为N;A和C同族,B和D同族,C离子和B离子具有相同的电子层结构,则C为Na、D为P;A和B﹑D﹑E均能形成共价型化合物,C和E形成CE型的化合物,则E的化合价为-1,最外层含有7个电子,原子序数大于Na,则E为Cl元素。
(1)电子层越多、原子半径越大,电子层相同时,核电荷数越小,原子半径越大,则上述元素中,Na原子半价最大;同一周期中,原子序数越大,非金属性越强,则Cl的非金属性最强,故答案为:Na;Cl;
(2)非金属性Cl>P,N>P,则热稳定性最差的是为PH3,故答案为:PH3;
(3)HCl与氨气反应生成氯化铵,化学式为NH4Cl,氯化铵属于离子化合物,电子式为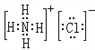 ,其中存在离子键、共价键,故答案为:
,其中存在离子键、共价键,故答案为: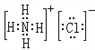 ;离子键和共价键;
;离子键和共价键;
(4)P元素的最高价氧化物的水化物的化学式为H3PO4或HPO3,故答案为:H3PO4或HPO3;
(5)E的单质为氯气,氯气与水反应生成盐酸与次氯酸,反应离子方程式为:Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】某溶液经分析,其中只含Na+、K+、Mg2+、Cl-、SO42-,已知其中Na+、K+、Mg2+、Cl-的浓度均为0.1 mol·L-1,则SO42- 的物质的量浓度为
A.0.1 mol·L-1 B.0.15 mol·L-1 C.0.2 mol·L-1 D.0.3 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方法正确的是
A. 乙烷中混有乙烯,将其通入酸性高锰酸钾溶液中洗气
B. 乙烯中混有二氧化硫,将其通入氢氧化钠溶液中洗气
C. 乙炔中混有硫化氢,将其通入溴水中洗气
D. 溴苯中混有溴,加入汽油,振荡,用汽油萃取出溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,pH值依次是8、9、10,则HX,HY,HZ的酸性由强到弱的顺序是
A. HY、HX、HZ B. HZ、HY、HX C. HX、HY、HZ D. HY、HZ、HX
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用电化学理论解释的是( )
A、轮船水线以下的船壳上镶嵌有一定量的锌块
B、镀锌的铁制品比镀锡的铁制品耐用
C、铝片不用特殊方法保存
D、锌跟稀硫酸反应时,滴入少量硫酸铜溶液后,反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯可通过石油裂解获得。下列有关乙烯性质的说法错误的是
A. 在常温常压下为液体 B. 能使酸性KMnO4溶液褪色
C. 可自身加成形成聚乙烯 D. 能使溴的CCl4溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com